Seit Ausbruch der Covid-19-Pandemie steht Swissmedic im Rampenlicht. Von ihr werden rasche Entscheide bei Impfstoffen und Therapeutika wie auch die Überwachung nach dem Marktzutritt von Arzneimitteln erwartet. Am 19. Dezember 2020 hat Swissmedic als erste westliche Behörde einen Covid-19-Impfstoff in einem ordentlichen Verfahren zugelassen.
20.12.2021
Für die Zulassung eines Arzneimittels muss die Gesuchstellerin Daten aus wissenschaftlichen Studien vorlegen. Für die Produktion in der Schweiz benötigt die Herstellerin zudem eine Bewilligung (so wird z.B. der Moderna-Impfstoff Spikevax durch die Lonza AG in Visp produziert). Die eingereichten Daten werden von Swissmedic gemäss international anerkannten Kriterien auf Qualität, Sicherheit und Wirksamkeit geprüft.
Wenn die Prüfung positiv ausfällt und der Nutzen die Risiken überwiegt, wird das Arzneimittel zugelassen und kann auf den Markt gebracht werden. Auch nach der Zulassung bleibt die Überwachung von Sicherheit, Wirksamkeit und Qualität Aufgabe von Swissmedic und der Zulassungsinhaberin. Dazu wertet Swissmedic nationale und internationale Berichte über Nebenwirkungen aus und ergreift bei Bedarf Massnahmen, um Risiken für die Bevölkerung zu minimieren.
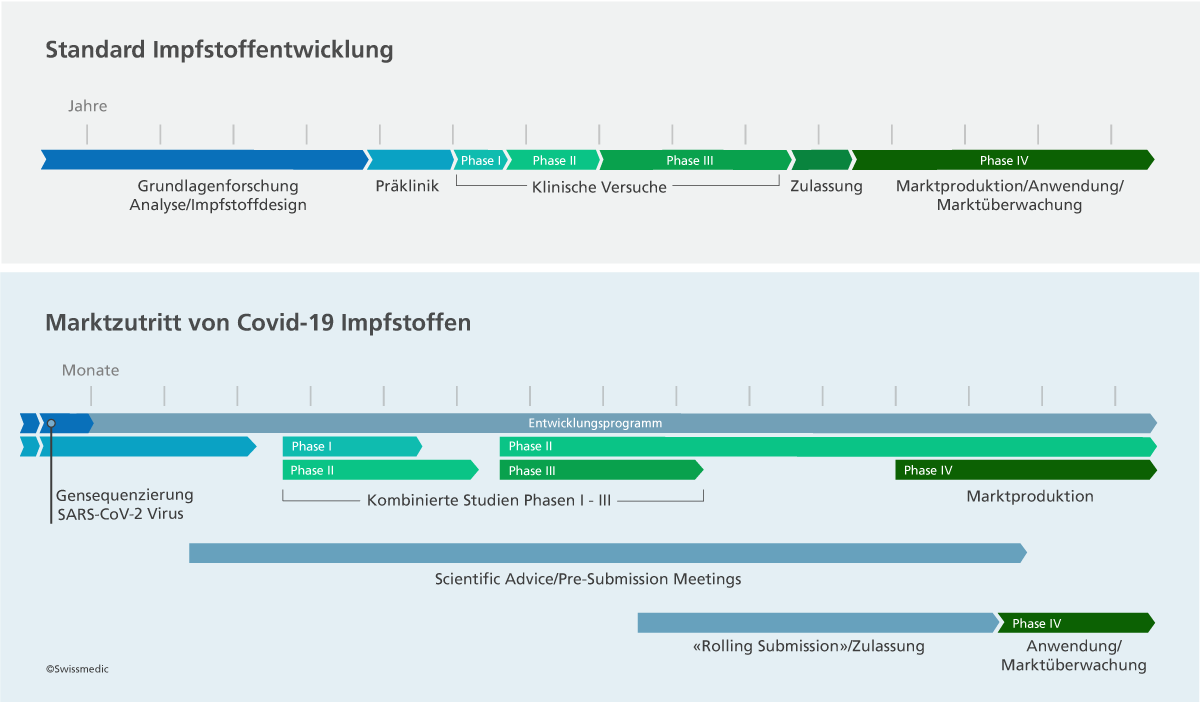
Der Zulassungsfahrplan
Der Fahrplan einer Zulassung wird massgeblich durch die Gesuchstellerin bestimmt. Entscheidend für eine effiziente Begutachtung und den Zulassungsentscheid sind die Qualität der wissenschaftlichen Daten. Dazu gehört auch die rasche Beantwortung der von Swissmedic an die Firma gestellten Fragen. Wichtig ist auch der Einreichungszeitpunkt des Zulassungsgesuches: Die Schweiz kommt, mit ihrem kleinen Absatzmarkt, selten zuerst an die Reihe.
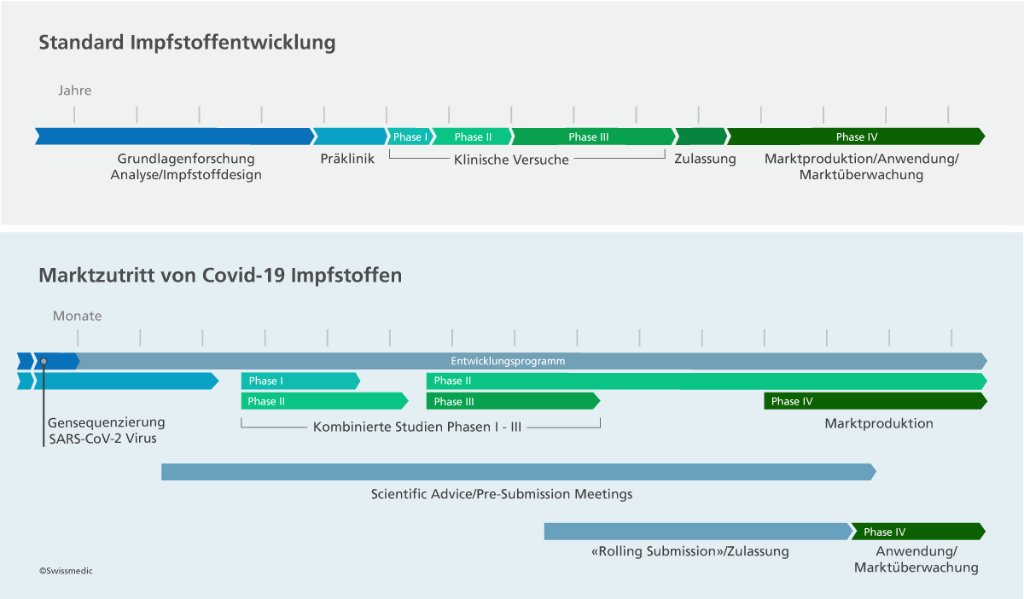
Zeit gewinnen: Die Rolling Submission beschleunigt Prozesse
In der ausserordentlichen Situation der Pandemie wurde für Covid-19-Arzneimittel die Möglichkeit der Rolling Submission geschaffen. Sie ist eine Sonderform des Zulassungsverfahrens, die eine rasche Zulassung dringend benötigter Arzneimittel gewährleisten soll. Gesuchstellerinnen müssen Swissmedic nicht mit der initialen Einreichung des Gesuchs schon ein vollständiges Dossier vorlegen. Stattdessen reichen sie erste verfügbare Datenpakete ein und unterbreiten einen Plan mit Terminen für die Nachreichung weiterer Datenpakete.
Die Rolling Submission hat den Vorteil, dass Swissmedic frühzeitig mit der Begutachtung der ersten Datenpakete beginnen und mit der Gesuchstellerin offene Punkte und Fragen fortlaufend bereinigen kann. So erhält Swissmedic bereits vor Abschluss der letzten klinischen Studien ein umfassendes Bild zum Nutzen-Risiko Profil eines Arzneimittels.
Sobald die Gesamtheit der wissenschaftlichen Evidenz die Wirksamkeit, Sicherheit und Qualität ausreichend belegt und der Nutzen die Risiken überwiegt, kann Swissmedic rasch den Zulassungsentscheid treffen.
Sind die klinischen Studien zum Zeitpunkt der Zulassung noch nicht vollständig abgeschlossen, stellt Swissmedic von Amtes wegen eine befristete Zulassung aus. Die Firma ist damit verpflichtet, die finalen Ergebnisse der klinischen Studien innert zwei Jahren vorzulegen. Stützen diese Ergebnisse die sichere und wirksame Anwendung, kann die befristete Zulassung in eine unbefristete Zulassung überführt werden.
Gesuchstellerinnen können auch schon vor der Einreichung eines Gesuchs mit Swissmedic Kontakt aufnehmen. Mit den sogenannten Scientific Advice- und Pre-Submission-Meetings, die Swissmedic in der Pandemie kostenlos anbietet, werden die Firmen in allen wissenschaftlichen, regulatorischen und organisatorischen Belangen bestmöglich beraten und unterstützt.
Auch international erfolgten die Zulassungsgesuche von Covid-19-Impfstoffen in rollierenden Verfahren. Dass diese der effizienten Arbeitsweise von Swissmedic entsprechen, zeigt sich daran, dass Swissmedic als erste westliche Behörde am 19. Dezember 2020 einen Covid-19-Impfstoff in einem ordentlichen Verfahren zugelassen hat.
Zusammenarbeit mit Partnerbehörden
Das Heilmittelgesetz bietet die Möglichkeit, Entscheide ausländischer Zulassungsbehörden zu berücksichtigen. Falls dieser Fall eintritt, entscheidet Swissmedic dennoch eigenständig, stützt ihren Entscheid jedoch auf die Begutachtungsberichte der Partnerbörde. So kann Swissmedic die Sicherheit der Patientinnen und Patienten in der Schweiz weiterhin gewährleisten. Verantwortung und haftpflichtrechtliche Aspekte können nicht an ein anderes Land oder eine andere Heilmittelbehörde delegiert werden
Als Teil der Wirtschafts- und Sicherheitsaufsicht überwacht Swissmedic auch nach der Zulassung den Markt und sorgt mit der Umsetzung der Regulierung, mit Inspektionen und der Sammlung von Meldungen für einen sicheren Heilmittelmarkt.
Verschiedene Arten der Zulassung
Swissmedic trifft ihre Entscheide gemäss den gesetzlichen Vorgaben im ordentlichen Verfahren. Dies bringt mit sich, dass für den Entscheid ausschliesslich die eingereichten wissenschaftlichen Daten analysiert und berücksichtigt werden dürfen.
In anderen Ländern (zum Beispiel in den USA oder Grossbritannien) gibt es sogenannte Notfallzulassungen. Diese erlauben, zusätzlich zu den eingereichten Daten auch die gesamtpandemische Lage eines Landes zu berücksichtigen. Dies hat der Gesetzgeber für die Schweiz explizit nicht vorgesehen hat. Er will damit für die Heilmittelbehörde Swissmedic eine maximale Unabhängigkeit sicherstellen.