Swissmedic est sous les feux de la rampe depuis le début de la pandémie de Covid-19. Le public attend en effet de l’institut qu’il statue rapidement sur les vaccins et les médicaments, et qu’il assure également la surveillance de ces produits après leur mise sur le marché. Swissmedic fut la première autorité occidentale à autoriser un vaccin contre le Covid-19 dans le cadre d’une procédure ordinaire le 19 décembre 2020.
20.12.2021
Lorsqu’un requérant souhaite faire autoriser un médicament, il doit soumettre des données issues d’études scientifiques. En outre, tout fabricant qui souhaite produire des médicaments en Suisse doit obtenir une autorisation d'exploitation (comme ce fut le cas pour l’entreprise Lonza AG à Visp, qui produit Spikevax, le vaccin de Moderna). Swissmedic analyse les données présentées à l’aune de critères de qualité, de sécurité et d’efficacité reconnus au niveau international.
Si le résultat de cet examen est positif et que les bénéfices dépassent les risques, le médicament est autorisé et peut être mis sur le marché. Mais même après avoir octroyé une autorisation, Swissmedic et le titulaire de cette autorisation sont tenus de continuer à surveiller la sécurité, l’efficacité et la qualité du médicament en question. Pour ce faire, Swissmedic évalue les rapports suisses et internationaux sur les effets indésirables et prend des mesures si besoin est, afin de réduire les risques pour la population.
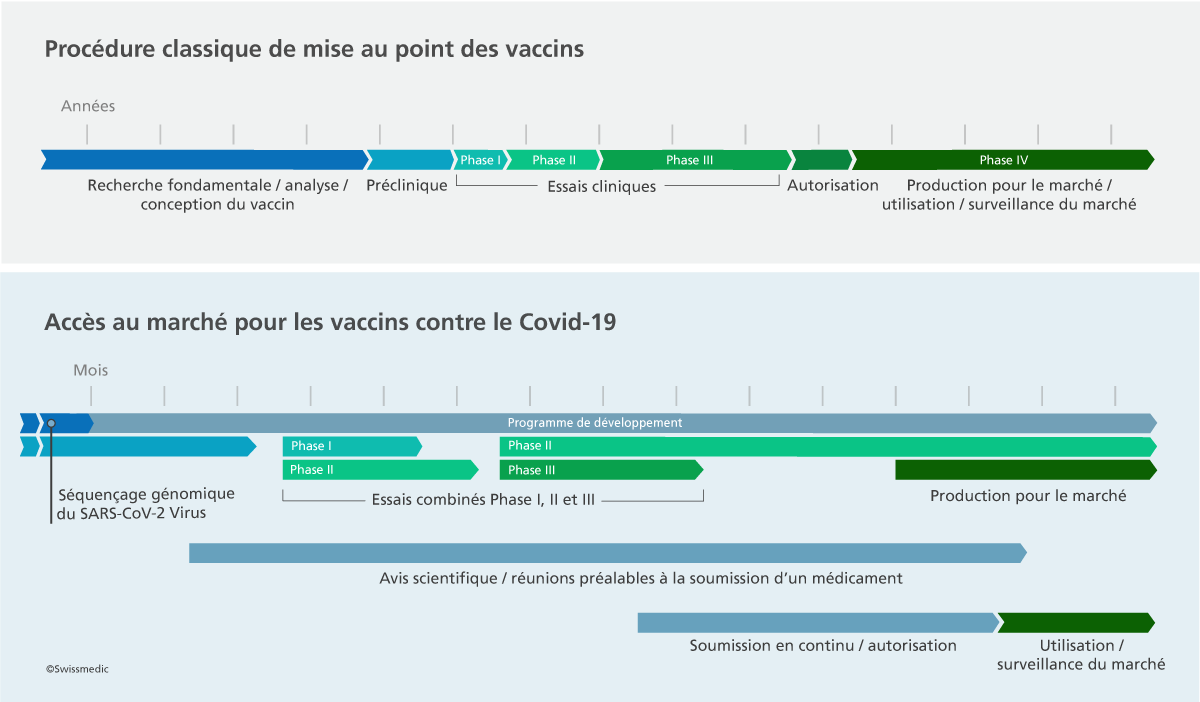
Déroulement de la procédure d’autorisation
C’est essentiellement le requérant qui détermine le déroulement de la procédure d’autorisation. L’efficacité de la procédure d’examen et l’octroi de la décision d’autorisation dépendent avant tout de la qualité des données scientifiques, ainsi que de la rapidité avec laquelle le requérant répond aux questions posées par Swissmedic. Un autre élément important est le moment auquel le requérant introduit sa demande d’autorisation, car avec ses débouchés commerciaux limités, la Suisse est rarement le premier pays auquel les entreprises s’adressent.
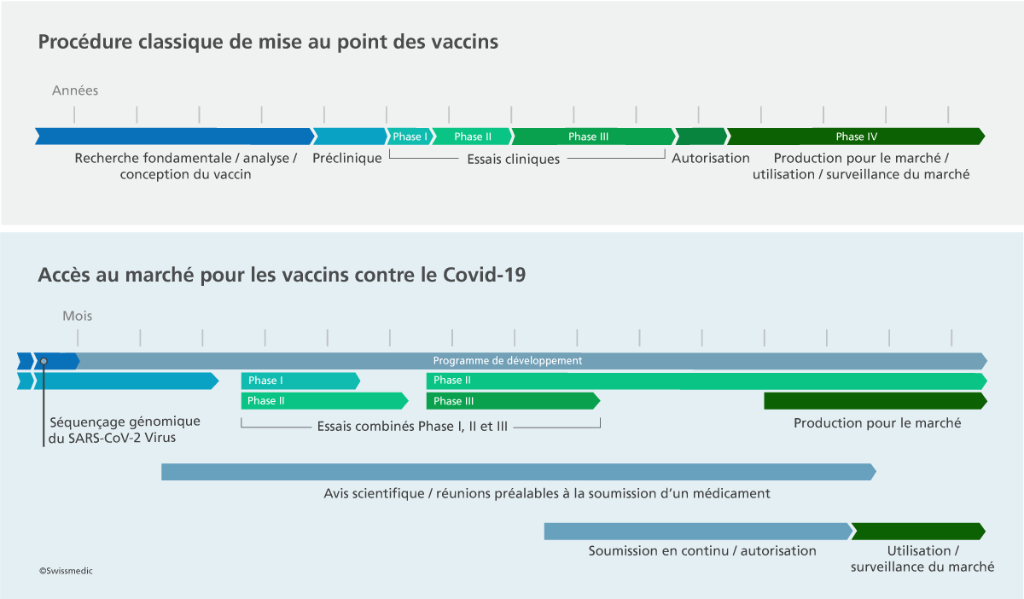
L’examen des dossiers en continu: une approche qui permet d’accélérer la procédure et de gagner du temps
Face à la pandémie et à la situation exceptionnelle qui en découlait, Swissmedic a créé une procédure d’examen des dossiers en continu (« rolling submission ») pour les médicaments contre le Covid-19. Il s'agit en l’occurrence d’une forme spécifique de la procédure d’autorisation, qui vise à garantir l’autorisation rapide des médicaments pour lesquels il existe un besoin urgent. En l’occurrence, les requérants ne sont pas tenus de présenter directement un dossier complet lorsqu’ils déposent leur demande pour la première fois : ils peuvent se contenter de transmettre à l’institut les premières séries de données dont ils disposent, avec un échéancier indiquant les dates auxquelles ils déposeront les autres séries de données.
L'avantage de cette procédure d’examen est que l’institut peut entamer d’emblée l’analyse des premières séries de données et éclaircir au fur et à mesure les points et questions en suspens avec le requérant. Il est ainsi en mesure de se faire déjà une idée globale du profil bénéfice-risques d’un médicament avant l’achèvement des derniers essais cliniques.
Swissmedic peut rendre rapidement sa décision d’autorisation dès que l’ensemble des preuves scientifiques fournies démontrent que le médicament en question est suffisamment efficace, sûr d’emploi et de première qualité, et que le bénéfice qu’il apporte dépasse les risques.
Lorsque les essais cliniques ne sont pas encore complètement achevés au moment de l’octroi de l’autorisation, Swissmedic délivre d’office une autorisation de durée limitée. L’entreprise dispose alors d’un délai de deux ans pour présenter les résultats finaux des essais cliniques. Si ces résultats confirment que l’utilisation du médicament est sûre et efficace, l'autorisation de durée limitée peut alors être convertie en une autorisation de durée illimitée.
Les requérants peuvent également prendre contact avec Swissmedic avant de déposer leur demande. En proposant gracieusement aux entreprises des « Scientific Advice Meetings » et des « Pre-Submission-Meetings » depuis le début de la pandémie, l’institut conseille et aide ces dernières au mieux en ce qui concerne tous les aspects scientifiques, réglementaires et organisationnels.
À l’étranger, les demandes d'autorisation de vaccins contre le Covid-19 font aussi l’objet de procédures d’examen en continu. Le fait que Swissmedic ait été la première autorité occidentale à autoriser un vaccin contre le Covid-19 le 19 décembre 2020 dans le cadre d’une procédure ordinaire témoigne du fait que ces procédures ont encore renforcé l’approche efficace de Swissmedic.
Collaboration avec les autorités partenaires à l’étranger
La loi sur les produits thérapeutiques offre la possibilité de prendre en considération les décisions rendues par d’autres autorités qui octroient des autorisations de mise sur le marché à l’étranger. Dans ce cas de figure, Swissmedic s’appuie sur les rapports d’expertise de ces autorités partenaires, mais prend sa décision de manière autonome, ce qui lui permet de continuer à garantir la sécurité des patients en Suisse. La responsabilité et les obligations en vertu du droit de la responsabilité civile ne peuvent en effet pas être délégués à un autre pays ou à une autre autorité de contrôle des produits thérapeutiques.
Dans le cadre de la surveillance de l’économie et de la sécurité, Swissmedic assure également la surveillance du marché après l’octroi des autorisations, et veille à ce que le marché des produits thérapeutiques soit sûr en faisant respecter la réglementation, en procédant à des inspections, et en recueillant les déclarations d’effets indésirables.
Différents types d’autorisations
Les décisions que rend Swissmedic dans le cadre des procédures ordinaires sont régies par les prescriptions légales, ce qui signifie que ces décisions ne peuvent reposer que sur l’analyse des données scientifiques présentées.
Dans d’autres pays (dont les États-Unis et la Grande-Bretagne), il existe des procédures dites « d’autorisation d’urgence » qui permettent de prendre également en considération le contexte global de pandémie dans lequel se trouve le pays, en sus des données soumises. Le législateur suisse n’a cependant pas prévu explicitement cette possibilité car il souhaite garantir au maximum l’indépendance de l’autorité de contrôle des produits thérapeutiques qu’est Swissmedic.