swissdamed – swiss database on medical devices – ist eine von Swissmedic eingerichtete Datenbank zur Registrierung der Wirtschaftsakteure und Medizinprodukte inklusive In-vitro-Diagnostika auf dem Schweizer Markt*.
Ziel von swissdamed ist es, einen Überblick über die verantwortlichen Wirtschaftsakteure und die Medizinprodukte inklusive In-vitro-Diagnostika auf dem Schweizer Markt zu geben. In der Datenbank werden Informationen über Medizinprodukte und die beteiligten Unternehmen (Hersteller, Bevollmächtigte, Importeure) gesammelt und publiziert.
swissdamed enthält eine öffentlich zugängliche Webseite mit Suchfunktion. Diese wurde dafür konzipiert, Gesundheitsfachpersonen und der Öffentlichkeit einen Zugang zu Informationen zu den in der Schweiz in Verkehr gebrachten Medizinprodukten und In-vitro-Diagnostika und den verantwortlichen Wirtschaftsakteuren zu ermöglichen und damit die Transparenz zu verbessern.
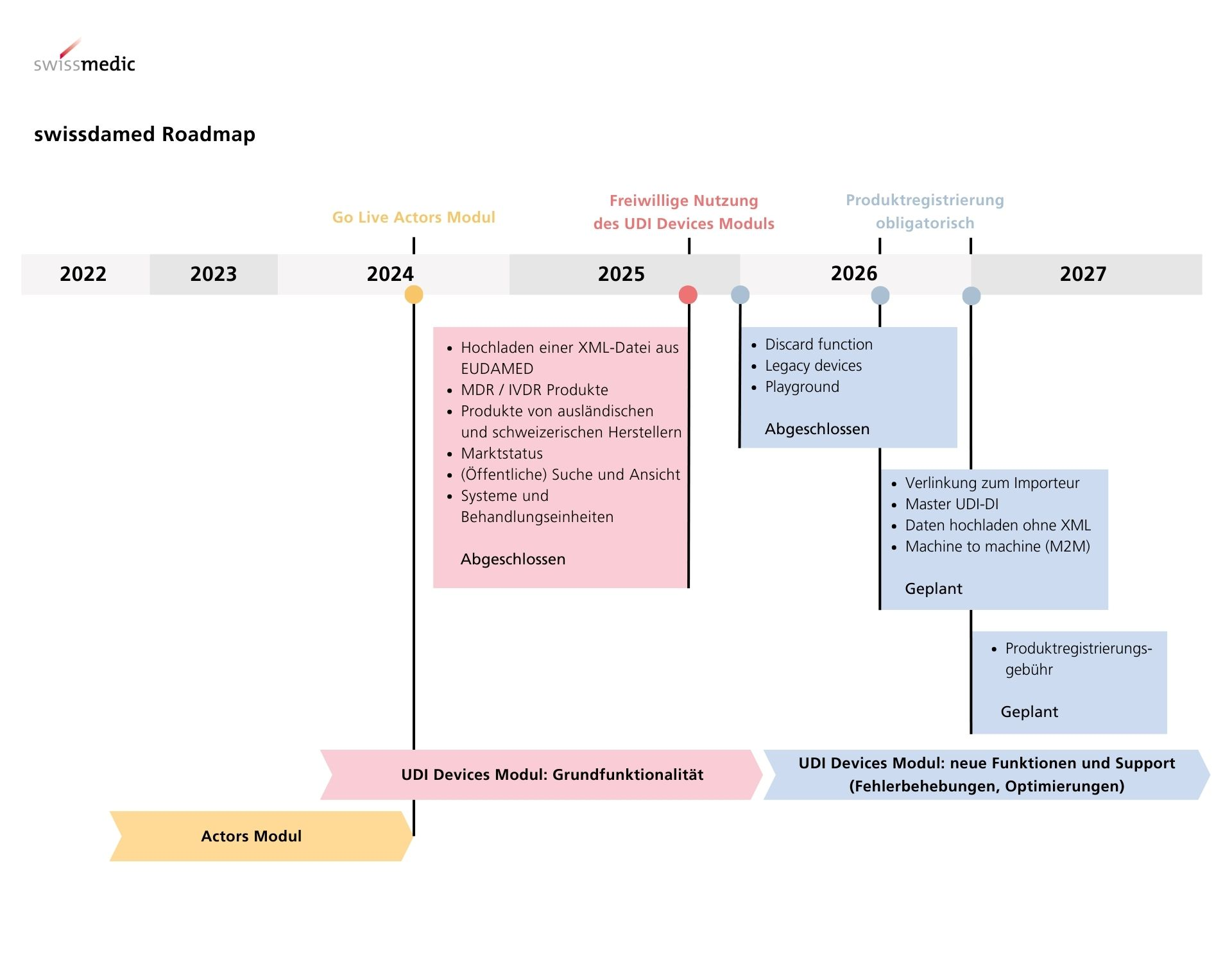
swissdamed besteht aus zwei Modulen, dem «Actors Modul» und dem «UDI Devices Modul». Um die Äquivalenz zwischen den Regulierungen der Schweiz und der EU möglichst zu erhalten und den Aufwand für Wirtschaftsakteure zu minimieren, orientiert sich swissdamed an den entsprechenden Modulen der europäischen Datenbank EUDAMED.
Es gibt keine Schnittstelle zwischen swissdamed und EUDAMED. Swissmedic kann dadurch keine Daten aus der EUDAMED übernehmen oder synchronisieren. Schweizer Hersteller, Personen, die Systeme und Behandlungseinheiten zusammenstellen, und Bevollmächtigte müssen Produktdaten aktiv auf swissdamed hochladen. Dafür wird aktuell eine XML-Datei im EUDAMED ‘GET DEVICE’ oder ‘POST DEVICE’ Format verwendet. Später werden weitere Upload Methoden möglich sein, wie beispielsweise Machine-to-Machine.