swissdamed – swiss database on medical devices – è una banca dati creata da Swissmedic per la registrazione degli operatori economici e dei dispositivi medici inclusi i dispositivi medico-diagnostici in vitro presenti sul mercato svizzero*.
L’obiettivo di swissdamed è fornire una panoramica degli operatori economici responsabili e dei dispositivi medici, inclusi i dispositivi medico-diagnostici in vitro, commercializzati in Svizzera. Nella banca dati vengono raccolte e pubblicate informazioni sui dispositivi medici e sulle aziende coinvolte (fabbricanti, mandatari, importatori).
swissdamed contiene una pagina web pubblicamente accessibile con funzione di ricerca. Questa è stata concepita per consentire ai professionisti della salute e al pubblico in generale di accedere alle informazioni sui dispositivi medici e sui dispositivi medico-diagnostici in vitro immessi in commercio in Svizzera nonché sugli operatori economici responsabili, migliorando così la trasparenza.
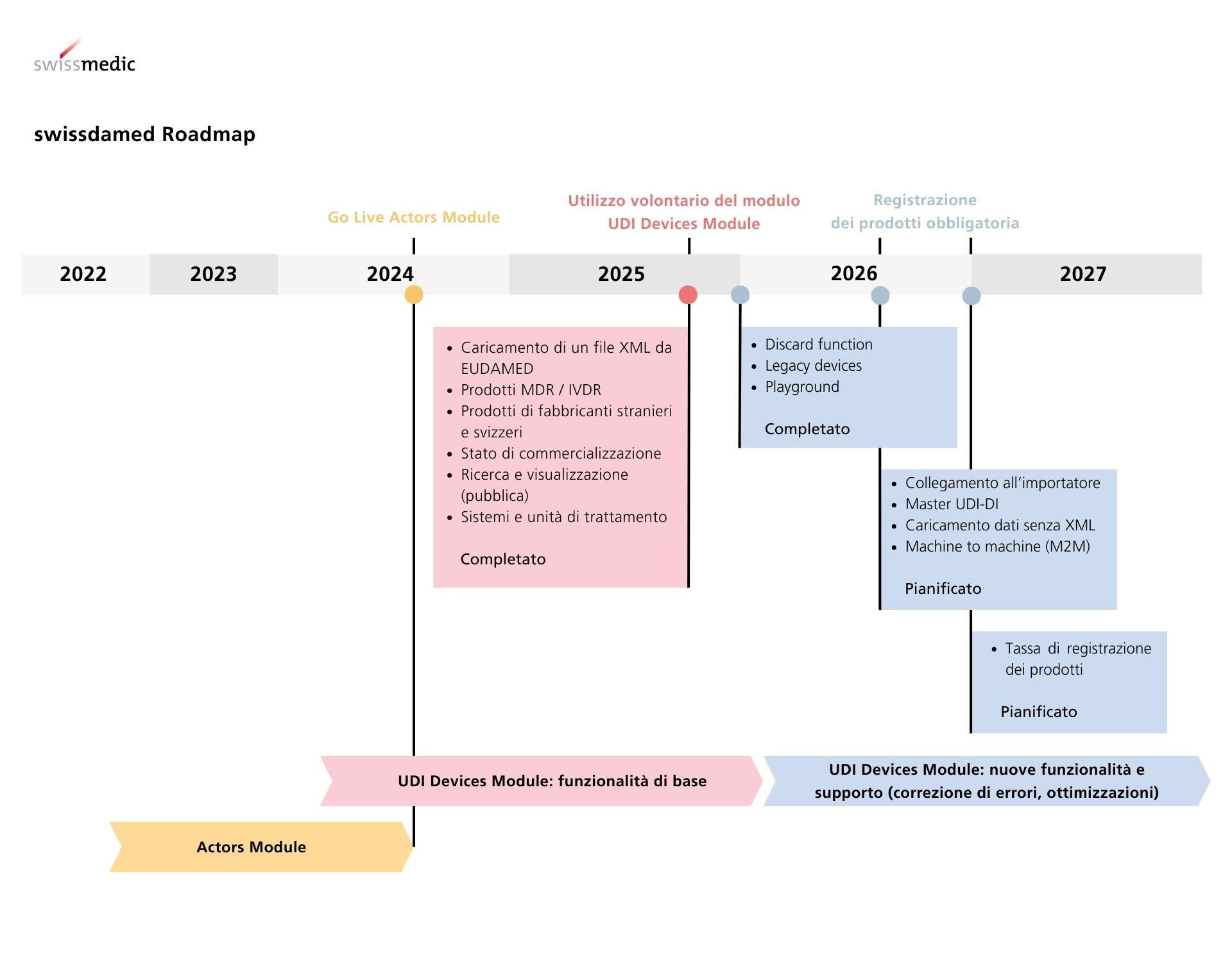
swissdamed è composta da due moduli, il modulo «Actors» e il modulo «UDI Devices». Per mantenere nel miglio modo possibile l’equivalenza tra la regolamentazione svizzera e quella dell’UE e per ridurre al minimo l’impegno di lavoro per gli operatori economici, swissdamed presenta moduli simili a quelli della banca dati europea EUDAMED.
Attualmente non esiste alcun collegamento tra swissdamed ed EUDAMED. Pertanto Swissmedic non può né importare né sincronizzare i dati da EUDAMED. I fabbricanti svizzeri, le persone che assemblano sistemi e kit procedurali così come i mandatari, devono caricare attivamente i dati dei dispositivi in swissdamed. A tale scopo, attualmente, si utilizza un file XML nel formato «GET DEVICE» o «POST DEVICE» di EUDAMED. In futuro saranno disponibili anche altri metodi di caricamento, come ad esempio la tecnologia Machine-to-Machine.