swissdamed – swiss database on medical devices – est une base de données mise en place par Swissmedic pour l’enregistrement des opérateurs économiques et des dispositifs médicaux, y compris les dispositifs de diagnostic in vitro, sur le marché suisse*.
L’objectif de swissdamed est de donner une vue d’ensemble des opérateurs économiques responsables et des dispositifs médicaux ainsi que des dispositifs de diagnostic in vitro sur le marché suisse. La base de données rassemble et publie des informations sur les dispositifs médicaux et les entreprises impliquées (fabricants, mandataires, importateurs).
swissdamed contient un site Internet en libre accès avec une fonction de recherche. Celle-ci a été conçue pour permettre aux professionnels de la santé et au public d’accéder à des informations sur les dispositifs médicaux et les dispositifs médicaux de diagnostic in vitro mis sur le marché en Suisse et sur les opérateurs économiques responsables, et ainsi d’améliorer la transparence.
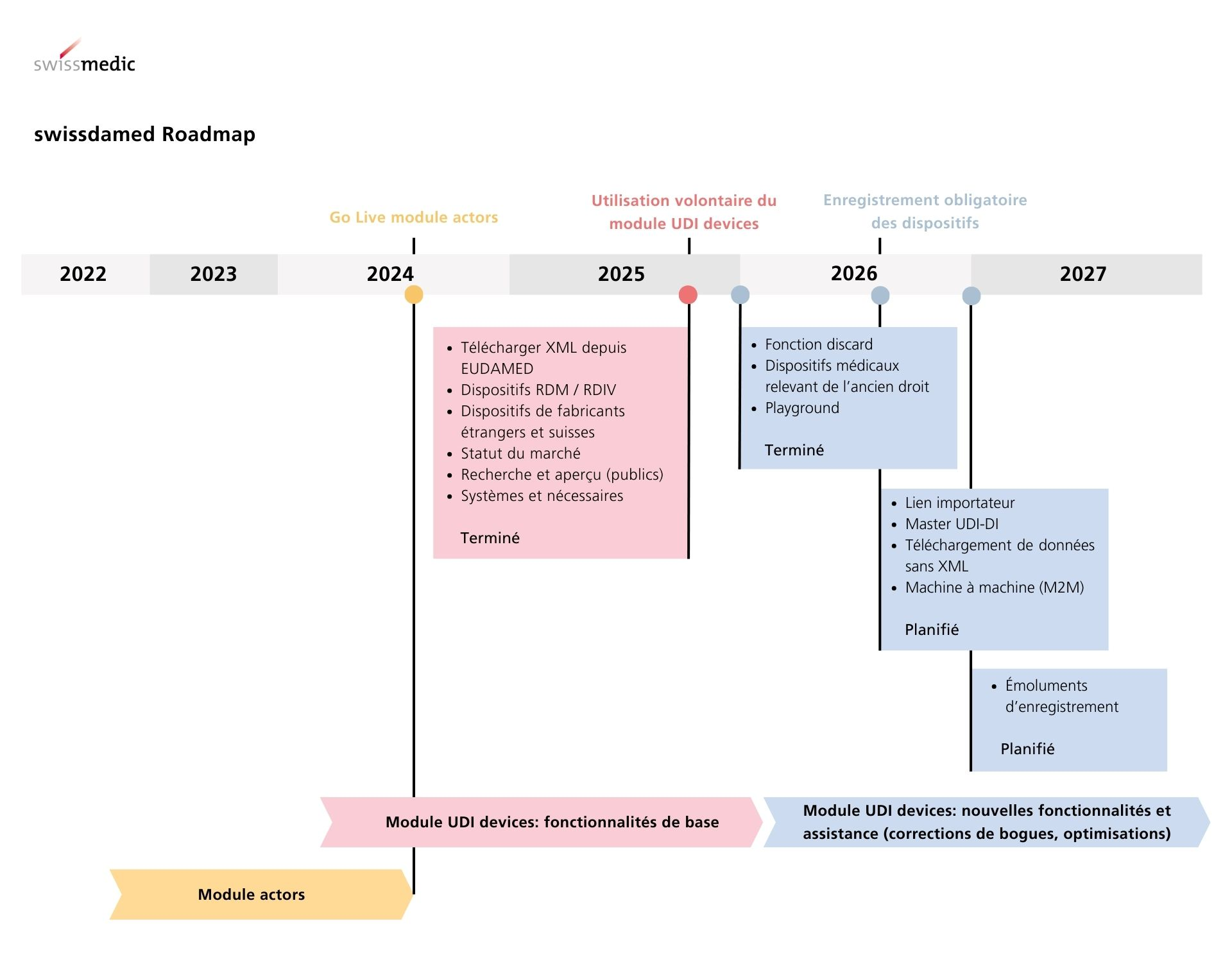
swissdamed se compose de deux modules, le module « Actors » et le module « UDI Devices ». Afin de conserver autant que possible l’équivalence entre les réglementations de la Suisse et de l’UE et de réduire au minimum la charge de travail pour les opérateurs économiques, swissdamed ressemble aux modules correspondants de la base de données européenne EUDAMED.
Il n’y a toutefois pas d’interface entre swissdamed et EUDAMED. Swissmedic ne peut ainsi pas reprendre ou synchroniser les données d’EUDAMED. Les fabricants suisses, les personnes qui assemblent des systèmes et des nécessaires, et les mandataires doivent télécharger activement les données relatives aux dispositifs sur swissdamed. Un fichier XML au format «GET DEVICE» ou «POST DEVICE» d’EUDAMED peut être utilisé à cet effet. D’autres méthodes de téléchargement comme par exemple la technologie Machine-to-Machine seront disponibles plus tard.