Swissmedic est chargé de contrôler la sécurité des médicaments. Ces activités de pharmacovigilance incluent la réception et l’évaluation de déclarations d’effets secondaires de médicaments et de vaccins, vaccins contre le Covid compris. Swissmedic ne répond cependant pas aux questions ayant trait à des traitements individuels ou à la vaccination et ne fournit pas non plus de recommandations. Pour obtenir des renseignements sur ces sujets, veuillez vous adresser à votre médecin traitant.
La loi suisse sur les produits thérapeutiques prévoit que les consommateurs, les patients et leurs organisations ainsi que les tiers intéressés peuvent déclarer à Swissmedic les effets indésirables de produits thérapeutiques et les incidents qui leur sont imputables.
Veuillez garder à l’esprit que cette déclaration ne remplace pas un entretien avec votre médecin ou votre pharmacien si des effets indésirables présumés ou un incident vous préoccupent.
Déclarer un effet secondaire général d’un médicament ou un effet secondaire présumé en rapport avec un vaccin contre le COVID-19
Tous les particuliers peuvent déclarer à Swissmedic des effets secondaires présumés de médicaments à usage humain en utilisant un formulaire en ligne. Il est possible de déclarer un effet secondaire pour soi-même ou au nom d’une autre personne (un enfant ou un proche, par exemple).
Remarques importantes concernant la déclaration par des particuliers
Veuillez noter qu’une déclaration d’effets secondaires ne remplace ni un examen médical ni un diagnostic. Même si, dans un cas particulier, on constate une relation temporelle entre l’administration d’un médicament ou une vaccination et l’apparition d’un symptôme ou d’une maladie, cela ne signifie pas obligatoirement que le médicament ou le vaccin en était effectivement la cause. Seul un diagnostic médical permet d’exclure d’autres causes possibles susceptibles de nécessiter des mesures thérapeutiques ciblées.
Si vous remarquez des symptômes qui pourraient être un effet secondaire, adressez-vous en premier lieu à la personne ou à l’établissement qui vous a prescrit, remis ou administré les médicaments. En cas de troubles, consultez toujours votre médecin traitant. Les professionnels de la santé sont à même d’évaluer s’il s’agit d’un effet secondaire à déclarer ou de troubles ayant une autre cause. Le cas échéant, demandez au professionnel de la santé auquel vous vous êtes adressé-e (médecin, pharmacien-ne) de déclarer l’effet secondaire.
En déclarant les effets secondaires ou les suspicions de tels événements, vous contribuez de manière importante à la sécurité des médicaments et des vaccins. Vous comprendrez toutefois que Swissmedic ne répond pas aux questions individuelles relatives à des traitements ou à la santé et ne formule aucune recommandation dans ces domaines.
Informations générales
FAQ
Nécessité de la pharmacovigilance
Il faut plusieurs années pour développer un médicament. L’efficacité et la sécurité d’emploi d’une nouvelle préparation sont étudiées sur une population, en règle générale réduite à quelques milliers de volontaires et de patients sélectionnés selon des critères très stricts et placés sous étroite surveillance. Par conséquent, seuls les effets indésirables les plus fréquents, dus pour la plupart au mécanisme pharmacologique, peuvent être identifiés au cours du développement clinique.
Après sa mise sur le marché, le médicament est administré à une population bien plus large qui présente souvent de multiples comorbidités, ce qui peut faire évoluer le profil de sécurité connu. En effet, à partir de ce moment-là, des effets indésirables, dont ceux qui n’apparaissent que sporadiquement ou indépendamment des propriétés pharmacologiques de la substance, peuvent être observés plus fréquemment. Ces effets indésirables observés dans la pratique médicale quotidienne doivent être rapidement déclarés. C’est par une transmission systématique de ces informations au Centre national de pharmacovigilance de Swissmedic que des risques encore inconnus pourront être identifiés et contrôlés.
Le Centre national de pharmacovigilance de Swissmedic reçoit et traite les déclarations d’effets indésirables de médicaments établies. Il est soutenu dans cette tâche par cinq centres régionaux, qui sont rattachés à un service universitaire de pharmacologie clinique et traitent notamment les déclarations qui ont une forte valeur de signal transmises par des professionnels. De son côté, l’industrie pharmaceutique transmet à Swissmedic les déclarations d’effets indésirables qu’elle reçoit. Le Centre national de pharmacovigilance travaille, quant à lui, en étroite collaboration avec le Centre international de pharmacovigilance de l’Organisation mondiale de la Santé (OMS).
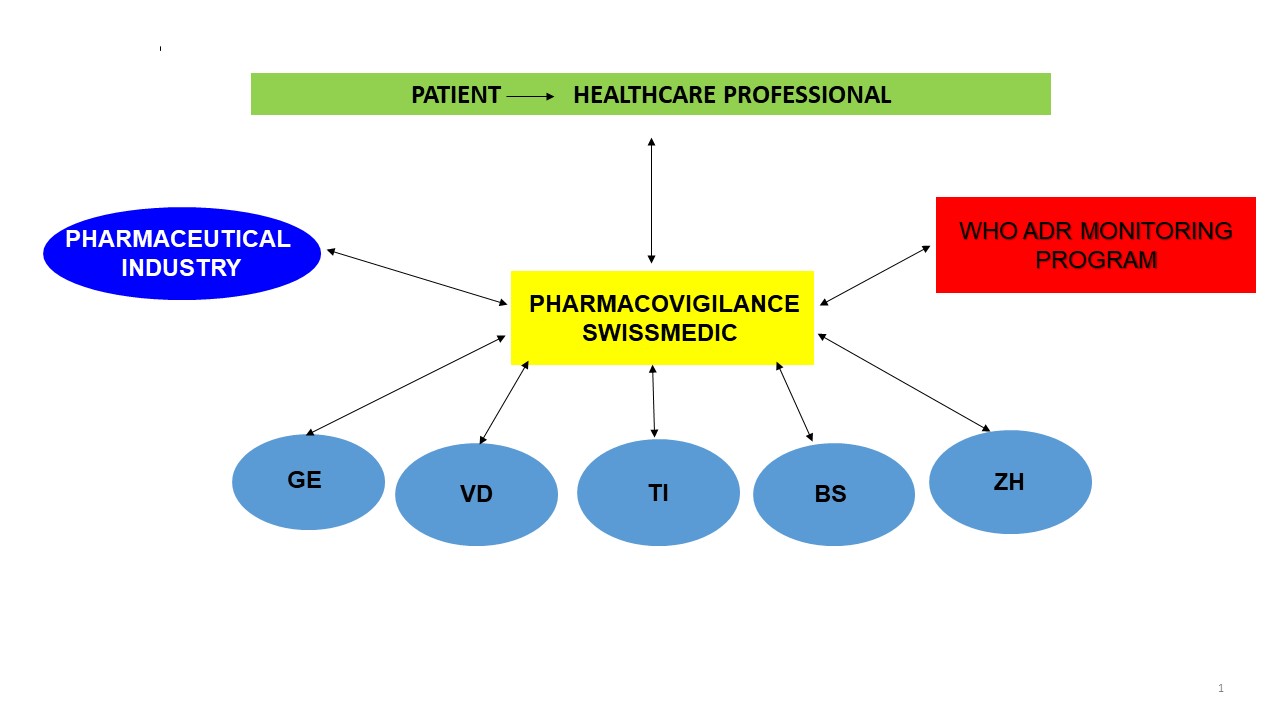
En vertu de la loi sur les produits thérapeutiques, les effets indésirables doivent être déclarés lorsqu’ils sont graves, inconnus ou insuffisamment décrits dans l’information professionnelle du médicament concerné.
Sont considérés comme effets indésirables graves:
- les cas ayant entraîné le décès;
- les cas ayant présenté un risque potentiellement létal;
- les cas requérant l’hospitalisation ou susceptibles de la prolonger;
- les cas ayant provoqué un handicap permanent ou sérieux;
- les autres cas jugés médicalement importants (quand, par exemple, une intervention médicale opportune a permis d’éviter les situations susmentionnées).
De tels effets indésirables doivent être annoncés dans un délai de 15 jours après leur identification.
En revanche, les effets indésirables qui ne présentent pas les critères de gravité susmentionnés doivent être déclarés dans les 60 jours.
Il n'est pas nécessaire d'avoir confirmation d'une relation de cause à effet entre un événement et un médicament pour déclarer un effet indésirable: la suspicion seule est suffisante pour donner lieu à une annonce.
Les cas d'abus, de dépendance et de toxicomanie ne sont pas considérés comme des effets indésirables au sens strict de la définition correspondante de l'OMS, car celle-ci se réfère à l'utilisation habituelle du médicament à des doses normales. Cependant, ces cas doivent également faire l'objet d'annonces. Ces informations sont en effet importantes malgré tout pour évaluer la sécurité d'emploi d'un médicament et doivent par conséquent aussi être transmises aux instances compétentes.
La loi sur les produits thérapeutiques soumet tous les professionnels de la santé autorisés à prescrire, à remettre ou à utiliser des médicaments à l’obligation de déclarer. Les entreprises pharmaceutiques qui fabriquent des médicaments ou distribuent des médicaments prêts à l’emploi sont elles aussi soumises à l’obligation de déclarer.
Les patients ont également la possibilité de déclarer des effets indésirables causés par un traitement médicamenteux. Mais dans ce cas, il est souhaitable, mais non obligatoire, que le patient en discute préalablement avec son médecin de famille et qu’ils complètent ensemble la déclaration, de telle manière que les indications sur les conclusions d’éventuelles investigations soient aussi précises que possible.
Particuliers
Même s’ils ne disposent pas de connaissances médicales, les patients, leurs proches ou les tiers intéressés peuvent aussi déclarer à Swissmedic des effets secondaires et des incidents par voie électronique. La réception de la déclaration est automatiquement confirmée au sein même de l’application. Aucun accusé de réception supplémentaire n’est envoyé par e-mail.
Personnes exerçant une profession médicale / professionnels de la santé
Pour les professionnels de la santé, la méthode privilégiée est la déclaration électronique via le portail ElViS. ElViS permet également la transmission de documents liés à un cas donné tels que des rapports de laboratoire ou de sortie.
Entreprises
Les titulaires d’autorisation peuvent transmettre les cas d’effets indésirables présumés de médicaments soit via le portail ElViS (système de vigilance électronique), soit via une passerelle (Gateway) pour l’échange électronique de rapports de cas individuels.
L’équipe Pharmacovigilance de Swissmedic examine dans le détail les déclarations qu’elle reçoit afin de déceler de nouveaux risques. Lorsqu’elle en identifie, elle évalue la nécessité d’agir et prend les mesures qui s’imposent en collaboration avec les divisions de Swissmedic en charge de la préparation concernée.
Support/Contact
Adresse
Swissmedic
Section Pharmacovigilance
Hallerstrasse 7
3012 Berne (Suisse)
Avertissement concernant les demandes de renseignements
Veuillez garder à l’esprit que Swissmedic ne peut pas répondre aux questions individuelles relatives à des traitements ou à des vaccins et ni formuler aucune recommandation dans ces domaines. Veuillez toujours vous adresser à votre médecin pour le diagnostic et le traitement des symptômes ou des troubles.
Dernière modification 15.12.2025

