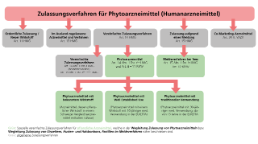
Für Phytoarzneimittel im vereinfachten Zulassungsverfahren nach Art. 14 cbis HMG (SR 812.21) in Verbindung mit Art. 8 - 11 KPAV (SR 812.212.24) können die Ergebnisse der pharmakologischen, toxikologischen und der klinischen Prüfungen, einschliesslich sämtlicher Ergebnisse aus Prüfungen in besonderen Bevölkerungsgruppen, durch einen bibliografischen Nachweis der Wirksamkeit und Sicherheit ersetzt werden.
Phytoarzneimittel mit bekanntem Wirkstoff
Ein Arzneimittel, dessen Wirkstoff in einem anderen Arzneimittel enthalten ist, welches von der Swissmedic zugelassen ist oder war,– kann vereinfacht zugelassen werden.
Die Wegleitung Zulassung Phytoarzneimittel, Kapitel 7.2.1 beschreibt die Anforderungen an die Zulassung für Phytoarzneimittel mit bekanntem Wirkstoff.
Das Zulassungsgesuch muss eine vollständige Dokumentation zur Qualität, zur Toxikologie und Pharmakologie und zur Klinik umfassen. Die Antragstellerin muss den Nachweis erbringen, dass das Phytoarzneimittel mit einem in der Schweiz zugelassenen Arzneimittel (= Referenzarzneimittel) therapeutisch oder pharmazeutisch äquivalent ist. Für die bekannten Aspekte kann auf das zugelassene Referenzarzneimittel abgestützt und mit bibliographischen Referenzen belegt werden. Ein etwaiger Unterlagenschutz ist zu berücksichtigen.
Die Wegleitung «Zulassung Humanarzneimittel mit bekanntem Wirkstoff» – findet hingegen keine Anwendung bei Phytoarzneimitteln.
Phytoarzneimittel mit «well-established use»
Für Phytoarzneimittel mit «well-established use» muss der pflanzliche Wirkstoff seit mindestens 10 Jahren in der beantragten Indikation und Anwendung in der Schweiz oder der EU/EFTA als Arzneimittel medizinisch verwendet werden. Es muss eine vollständige Dokumentation zur Qualität vorliegen. Ferner müssen ausreichende Studien zum Beleg der Wirksamkeit und Sicherheit in der wissenschaftlichen Literatur verfügbar sein (siehe Wegleitung Zulassung Phytoarzneimittel, Kapitel 7.2.2.).
Phytoarzneimittel mit traditioneller Verwendung
Wird für das angemeldete Phytoarzneimittel eine traditionelle Anwendung beantragt, ist eine Zusammenfassung derjenigen Unterlagen erforderlich, die belegen, dass das Phytoarzneimittel oder ein mit diesem vergleichbaren Arzneimittel (Vergleichsarzneimittel) seit mindestens 30 Jahren medizinisch verwendet wird, davon mindestens 15 Jahre in einem EU- / EFTA- Land. Die Wirksamkeit ist aufgrund der langjährigen Anwendung und Erfahrung plausibilisiert, während die Sicherheit durch eine ausreichende Dokumentation belegt ist (siehe Wegleitung Zulassung Phytoarzneimittel, Kapitel 7.2.3.). Aufgrund der traditionell abgeleiteten Indikation darf das Arzneimittel nicht verschreibungspflichtig sein bzw. keine ärztliche Diagnose resp. ärztlich überwachte Therapie erfordern.
Mitgeltende Dokumente sind zu finden unter:
Letzte Änderung 25.02.2025