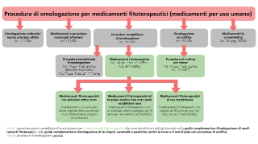
Per i medicamenti fitoterapeutici con procedure semplificate d’omologazione ai sensi dell’art. 14 lett. cbis LATer (RS 812.21) in combinato disposto con gli artt. 8-11 OMCF (RS 812.212.24), i risultati degli esami farmacologici, tossicologici e clinici, compresi tutti i risultati riguardanti gli esami compiuti in particolari gruppi di popolazione, possono essere sostituiti da una prova bibliografica dell’efficacia e della sicurezza.
Medicamenti fitoterapeutici con principio attivo noto
Un medicamento il cui principio attivo è contenuto in un altro medicamento che è o è stato omologato da Swissmedic, può essere omologato con procedura semplificata.
Il capitolo 7.2.1 della guida complementare Omologazione di medicamenti fitoterapeutici descrive i requisiti per l’omologazione di medicamenti fitoterapeutici con principio attivo noto.
La domanda di omologazione deve contenere una documentazione completa con informazioni sulla qualità e sui dati tossicologici, farmacologici e clinici. Il richiedente deve dimostrare che sotto il profilo terapeutico o farmaceutico il medicamento fitoterapeutico è equivalente a un medicamento omologato in Svizzera (= medicamento di riferimento). Per gli aspetti noti ci si può basare sul medicamento di riferimento omologato e fornire i riferimenti bibliografici. Eventuali criteri relativi alla protezione della documentazione vanno rispettati.
La guida complementare «Omologazione di medicamenti per uso umano con principio attivo noto» non si applica invece ai medicamenti fitoterapeutici.
Medicamenti fitoterapeutici di impiego medico ben noto (well established use)
Per i medicamenti fitoterapeutici di impiego medico ben noto (well established use), il principio attivo vegetale deve essere impiegato per uso medico da almeno 10 anni in Svizzera o nell’UE/AELS nell’indicazione e nell’applicazione proposte. Deve essere presentata una documentazione completa sulla qualità. Inoltre, nella letteratura scientifica devono essere presenti studi sufficienti che dimostrano l’efficacia e la sicurezza (cfr. capitolo 7.2.2 della guida complementare Omologazione di medicamenti fitoterapeutici).
Medicamenti fitoterapeutici di uso tradizionale
Se si richiede l’uso tradizionale per il medicamento fitoterapeutico proposto, è necessario inserire una sintesi della documentazione che dimostra che il medicamento fitoterapeutico o un medicamento comparabile (medicamento di riferimento) è utilizzato per uso medico da almeno 30 anni, dei quali almeno 15 in un Paese UE/EFTA. L’efficacia è plausibilizzata grazie all’applicazione e all’esperienza pluriennale, mentre la sicurezza è comprovata da un’adeguata documentazione (cfr. capitolo 7.2.3 della guida complementare Omologazione di medicamenti fitoterapeutici). Poiché l’indicazione è derivata dalla tradizione, il medicamento non deve essere soggetto all’obbligo di prescrizione né richiedere una diagnosi medica o una terapia sorvegliata da un medico.
I documenti applicabili sono disponibili sotto:
Ultima modifica 25.02.2025