Les médicaments asiatiques sont classés dans la catégorie des médicaments complémentaires et comprennent, au sens du chapitre 5 de l’OAMédcophy[1], des médicaments avec et sans indication, issus des trois seules orientations thérapeutiques asiatiques définies.
Vous trouverez d’autres documents applicables sous:
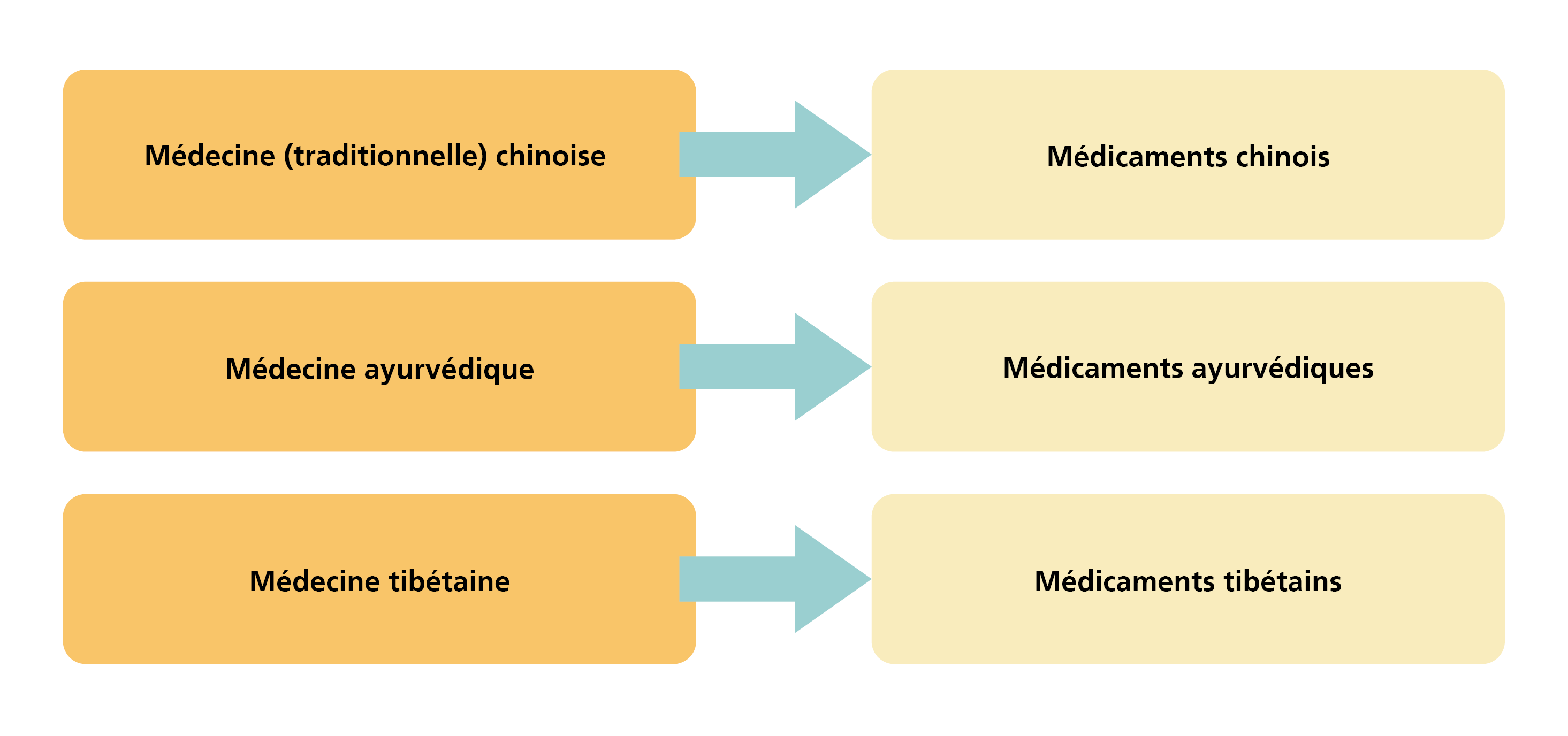
Les substances contenues dans les médicaments asiatiques et les préparations fabriquées à partir de celles-ci, de même que les compositions, les formes pharmaceutiques et les champs d’application sont dérivés de l’usage traditionnel et correspondent aux théories de l’orientation thérapeutique asiatique correspondante.
Pour les médicaments avec indication, les champs d’application sont définis et approuvés conformément aux théories de l’orientation thérapeutique correspondante, tandis que les médicaments sans indication sont utilisés par des professionnels de l’orientation thérapeutique concernée dans le cadre d’une thérapie individuelle.
Selon les prescriptions et les exigences à remplir, différentes procédures peuvent être employées pour l’autorisation des médicaments asiatiques au sens du chapitre 5 de l’OAMédcophy:
------------
[1] Ordonnance de l’Institut suisse des produits thérapeutiques sur l’autorisation simplifiée et la procédure de déclaration des médicaments complémentaires et des phytomédicaments (RS 812.212.24)
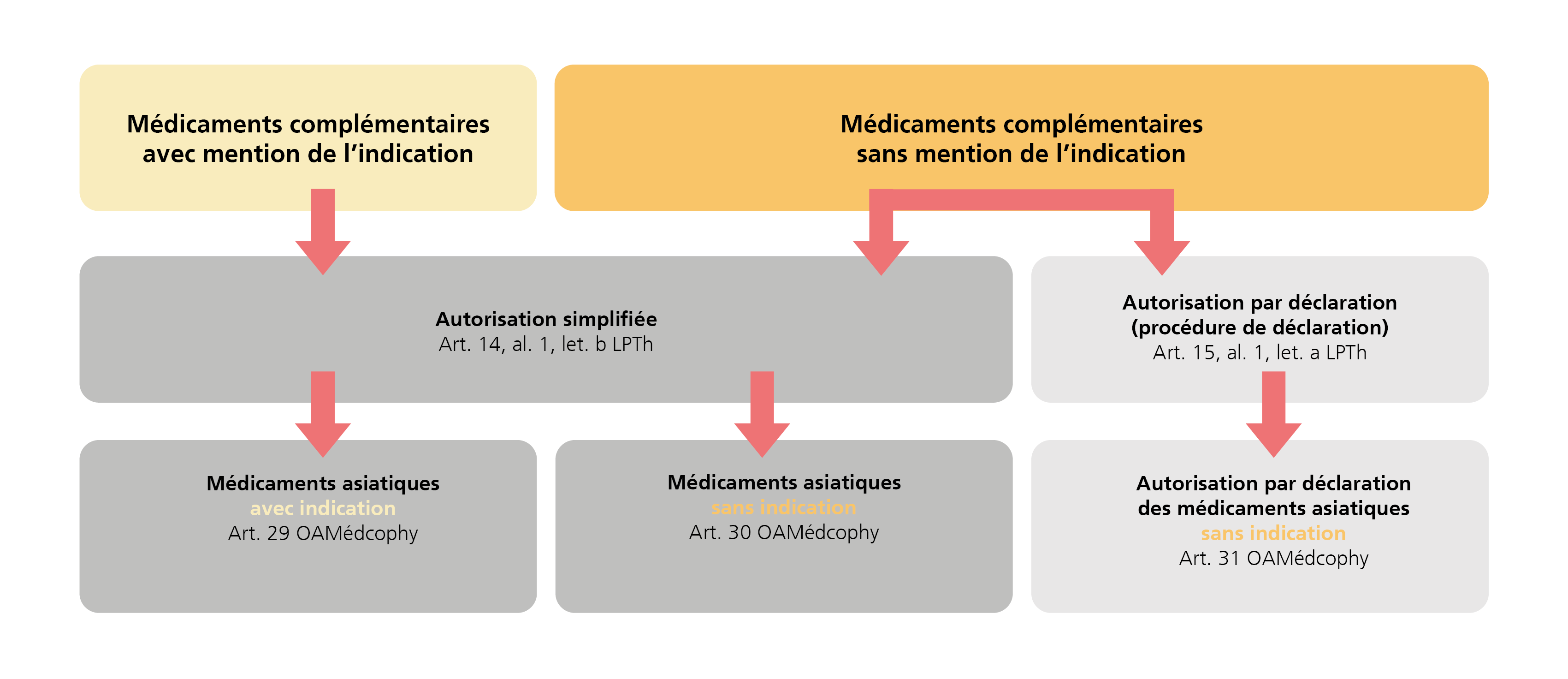
Les procédures diffèrent quant à l’ampleur de la documentation à fournir dans le cadre de la demande d’autorisation.
Vous trouverez de plus amples informations dans le Guide complémentaire Autorisation de médicaments asiatiques HMV4.

