Ausgangslage
In der ästhetischen Medizin, jedoch auch in anderen medizinischen Fachbereichen, werden vermehrt Behandlungen basierend auf der Transplantation von Eigenfett und daraus hergestellter Stromal Vascular Fraction (SVF) angeboten. Hierzu wird subkutanes Fettgewebe eines Patienten entnommen, auf verschiedene Arten aufbereitet und anschliessend an einer anderen Stelle demselben Patienten (autolog) zu unterschiedlichen Indikationen transplantiert, wie beispielsweise zum Volumenaufbau, zur Hautregeneration oder zur Behandlung von Arthrose. Die Transplantation von Fettgewebe und SVF werden durch das Transplantationsgesetz (TpG, SR 810.21), das Heilmittelgesetz (HMG, SR 812.21) und das Humanforschungsgesetz (SR 810.30) geregelt.
Fettgewebe und daraus hergestellte SVF, die Fett-Stammzellen, Prä-Adipozyten, Fibroblasten, Gefässendothelzellen und verschiedene Immunzellen und Wachstumsfaktoren enthält, können rechtlich in zwei Gruppen klassifiziert werden, für welche unterschiedliche gesetzliche Anforderungen gelten.
Die vorliegende Publikation soll die Grundlage für die rechtliche Klassifizierung und die entsprechenden gesetzlichen Anforderungen an Eigenfettgewebe und daraus hergestellter SVF zur autologen Transplantation erläutern.
Aufbereitung und Anwendung von Fettgewebe vs. Stromal Vascular Fraction
Mittels Liposuktion gewonnenes subkutanes Eigenfettgewebe wird vor der Transplantation je nach Zielanwendung unterschiedlich verarbeitet. Die Aufbereitungsarten lassen sich wie folgt zusammenfassen:
1. Durch mechanische Aufbereitung (z.B. mittels Sedimentation, Filtration, Zentrifugation) wird Fettgewebe von Blut, Serum, zerstörten Fettzellen und unerwünschte Flüssigkeiten befreit und anschliessend als aufbereitetes Fettgewebe vor allem zum Volumenaufbau transplantiert.
2. Durch Abtrennen der Fettzellen aus dem Fettgewebe wird SVF isoliert, welche vermehrt in der ästhetischen Medizin oder therapeutisch, wie beispielsweise für orthopädische Indikationen, transplantiert wird.
Die Isolierung der SVF aus abgesaugtem Fettgewebe erfolgt entweder mittels einer enzymatischen oder einer mechanischen Methode:
- Bei der enzymatischen Methode wird das abgesaugte Fettgewebe mit Hilfe einer Protease aufgespalten. Anschliessend wird über eine Zentrifugation die Ölfraktion (bestehend aus Fettzellen) und die wässrige Fraktion abgetrennt und so die SVF gewonnen.
- Bei der mechanischen Methode wird das abgesaugte Fettgewebe über Scherkräfte durch wiederholtes Transferieren des Fettgewebes durch Spritzen zu einer Emulsion verflüssigt. Anschliessend wird über eine Zentrifugation die Ölfraktion und die wässrige Fraktion abgetrennt und so die SVF gewonnen. Für die mechanische Gewinnung von SVF werden in der Praxis oftmals eigens dafür entwickelte Medizinprodukte verwendet.
Im Gegensatz zur Eigenfetttransplantation werden somit bei der Transplantation von autologer SVF nicht primär Fettzellen transplantiert, sondern Fett-Stammzellen, Prä-Adipozyten, Fibroblasten, Gefässendothelzellen und verschiedene Immunzellen und Wachstumsfaktoren.
Je nach Aufbereitungsart und Zielanwendung des aufbereiteten Fettgewebes oder SVF kommen unterschiedliche gesetzliche Regelungen zur Anwendung.
Rechtliche Klassifizierung von Fettgewebe und SVF zur autologen Transplantation
Aus rechtlicher Sicht können Fettgewebe und SVF zur autologen Transplantation in zwei Gruppen eingeteilt werden (Art. 2 der Transplantationsverordnung, TpV, SR 810.211), nämlich in:
1. «Autologe Transplantate» (Zellen und Gewebe zur autologen Transplantation)
Als Transplantate gelten Gewebe und Zellen, die
a. bei der Aufbereitung nicht substantiell bearbeitet werden, d.h. deren physiologischen Eigenschaften und Funktionen nach Bearbeitungsschritten unverändert bleiben (minimale Manipulation), und
b. an der Empfängerstelle die gleiche Funktion ausüben wie an der Entnahmestelle (homologe Anwendung).
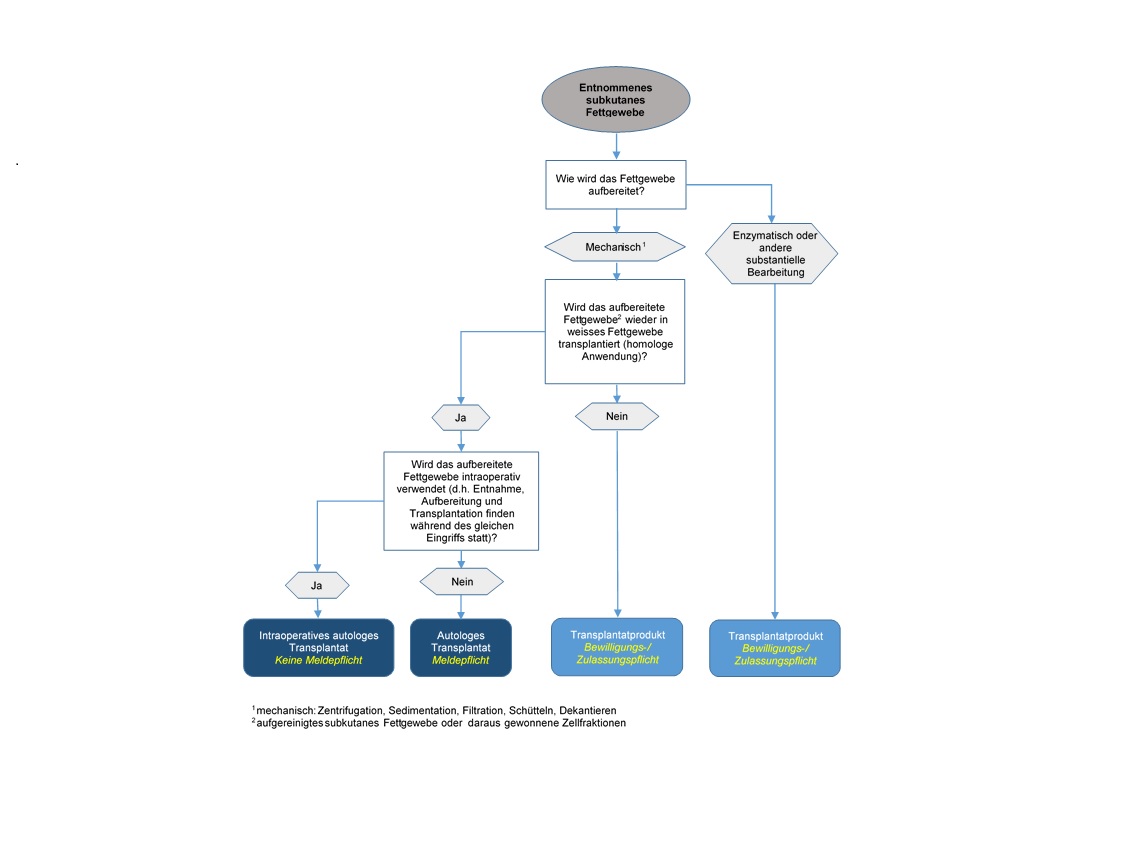
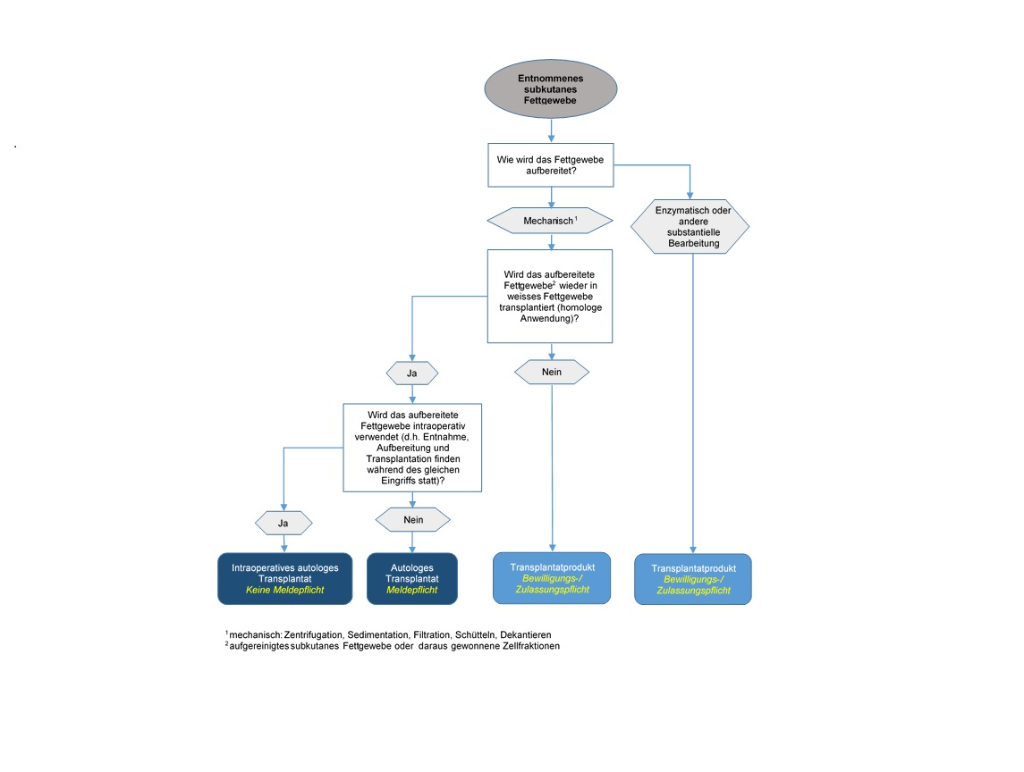
Autologe Transplantate unterstehen dem Transplantationsgesetz und seinen Ausführungsbestimmungen. Wer autologe Transplantate aufbereitet, lagert, weitergibt, einführt oder ausführt, muss diese vorgängig Swissmedic melden (Art. 15d, TpV). Ferner richtet sich der Umgang mit aufbereiteten Geweben und Zellen nach den Art. 13 und 14 der TpV.
Die oben genannte Meldepflicht nach Art. 15d der TpV sowie die Vorgaben zum Umgang mit Zellen und Gewebe nach Art. 13 und 14 der TpV gelten gemäss Art. 1, Abs. 2, Bst. b, und Art. 2, Abs. 1 Bst. b, nur für autologe Transplantate, wenn sie für eine «spätere Transplantation» aufbereitet werden. Ausgenommen von der Meldepflicht gelten somit Zellen und Gewebe, die während derselben Operation entnommen, aufbereitet und dem Patienten transplantiert werden (intraoperative Verwendung). Werden jedoch die Zellen und Gewebe vor der autologen Transplantation gelagert oder für eine spätere Transplantation aufbereitet, so gilt dies nicht mehr als intraoperative Verwendung und es gelten die oben genannten Bestimmungen für autologe Transplantate.
2. Transplantatprodukte:
Transplantatprodukte sind gemäss Art. 2, Bst. c und d, der TpV Produkte, die aus menschlichen Organen, Geweben oder Zellen bestehen oder solche enthalten, wobei
a. die Organe, Gewebe oder Zellen entweder substanziell bearbeitet wurden oder
b. an der Empfängerstelle nicht die gleiche Funktion ausüben wie an der Entnahmestelle (Funktionsänderung oder nicht-homologe Anwendung).
Transplantatprodukte unterstehen neben dem TpG auch dem HMG und seinen Ausführungsbestimmungen. Demnach benötigen alle Unternehmen und Institutionen, die Transplantatprodukte herstellen oder mit diesen umgehen, entsprechende Betriebsbewilligungen seitens Swissmedic (Art. 5 und 18, HMG).
Für die Anwendung an Patienten ist zudem für die Transplantatprodukte selbst (Art. 9, HMG) oder deren standardisierbares Herstellungsverfahren (Art. 32 der Arzneimittelverordnung VAM) eine Zulassung seitens Swissmedic erforderlich, oder sie dürfen nur im Rahmen einer durch Swissmedic bewilligten und kontrollierten klinischen Studie angewendet werden (Art. 54, HMG).
Erläuterung der Begriffe «substanzielle Bearbeitung» und «Funktionsänderung»
Bei der rechtlichen Einstufung von Eigenfettgewebe und daraus hergestellter SVF ist wie oben beschrieben entscheidend, ob die Gewebe und Zellen einer substanziellen Bearbeitung und/oder einer Funktionsänderung unterliegen:
1. Substanzielle Bearbeitung:
Als substanzielle Bearbeitung gilt gemäss Art. 2, Bst. d, der TpV die Vermehrung von Zellen über eine Zellkultur, die genetische Modifikation von Zellen und die Differenzierung oder Aktivierung von Zellen.
Mit dieser Definition der substanziellen Bearbeitung in der TpV wird auch der enzymatische Herstellungsschritt zur Einstufung von SVF als Transplantatprodukt herangezogen, da die enzymatische Aufbereitung die Zelloberfläche und somit die Differenzierung und Aktivierung der Zellen beeinflussen kann. Dies hat zur Folge, dass enzymatisch aufbereitetes Fettgewebe/SVF als Transplantatprodukt eingestuft wird. Mechanische Methoden, wie z.B. Filtration, Zentrifugation oder Dekantieren, gelten grundsätzlich als nicht-substantielle Bearbeitung, es sei denn sie ändern die physiologischen Eingeschalten oder die Funktion des Gewebes oder der Zellen.
2. Funktionsänderung:
Eine Funktionsänderung liegt dann vor, wenn entnommene Zellen oder Gewebe nicht dazu verwendet werden, um an einer anderen Stelle des menschlichen Körpers in der gleichen histologischen Umgebung ihre ursprüngliche, grundlegende Funktion auszuüben.
Da subkutanes Fettgewebe dem weissen Fettgewebe zugeordnet wird, kann nur bei Transplantation wiederum in weisses Fettgewebe von einer gleichen histologischen Umgebung ausgegangen werden.
Das heisst, wenn subkutanes Fettgewebe oder daraus hergestellte Zellfraktionen nicht wieder in weisses Fettgewebe zwecks Volumenaufbau/Rekonstruktion injiziert werden, sondern in ein anderes Zielgewebe (z. B. andere lockere Bindegewebe, Muskel- oder Hautgewebe) oder zu einem anderen Zweck, dann handelt es sich um eine Funktionsänderung. In diesem Fall kann nicht mehr davon ausgegangen werden, dass die Gewebe/Zellen ihre ursprüngliche, grundlegende Funktion ausüben.
Auf dieser Grundlage soll das nachfolgende Flussschema dabei helfen, die rechtliche Einstufung von autologem Fettgewebe und daraus hergestellter Zellfraktionen und die damit verbundenen Melde-, Zulassungs- oder Bewilligungspflichten festzustellen: