Contexte
De plus en plus de traitements fondés sur la transplantation de graisse autologue et de fraction vasculaire stromale (FVS) issue de cette dernière sont proposés en médecine esthétique ainsi que dans d'autres spécialisations médicales. Dans ce cadre, du tissu adipeux sous-cutané est prélevé chez un patient pour être préparé selon différents procédés avant d’être transplanté (de façon autologue) sur une autre zone du corps de ce même patient dans diverses indications (augmentation de volume, régénération des tissus cutanés, ou traitement de l'arthrose notamment). La transplantation de tissus adipeux et de FVS est régie par la loi sur la transplantation (LTx, RS 810.21), par la loi sur les produits thérapeutiques (LPTh, RS 812.21) et par la loi relative à la recherche sur l’être humain (LRH, RS 810.30).
Composés de cellules souches graisseuses, de préadipocytes, de fibroblastes, de cellules endothéliales vasculaires, ainsi que de cellules immunitaires et de facteurs de croissance variés, les tissus adipeux et la FVS issue de ces derniers peuvent être classés selon la loi dans deux groupes qui doivent satisfaire à des exigences légales différentes.
La présente publication entend poser les jalons de cette classification légale et expliquer les exigences que doivent respecter, selon la loi, les tissus adipeux autologues et la FVS extraite de ces derniers lorsque ces substances sont destinées à des transplantations autologues.
Préparation et utilisation du tissu adipeux / de la fraction vasculaire stromale
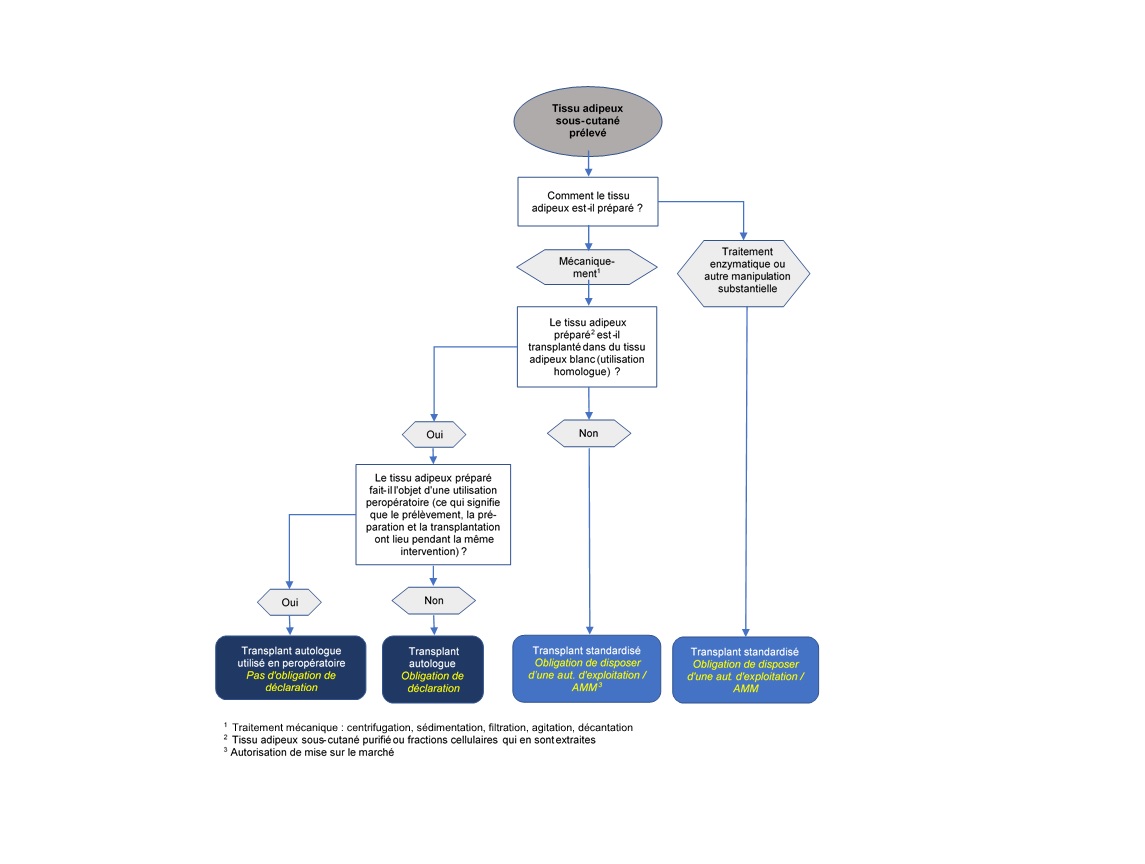
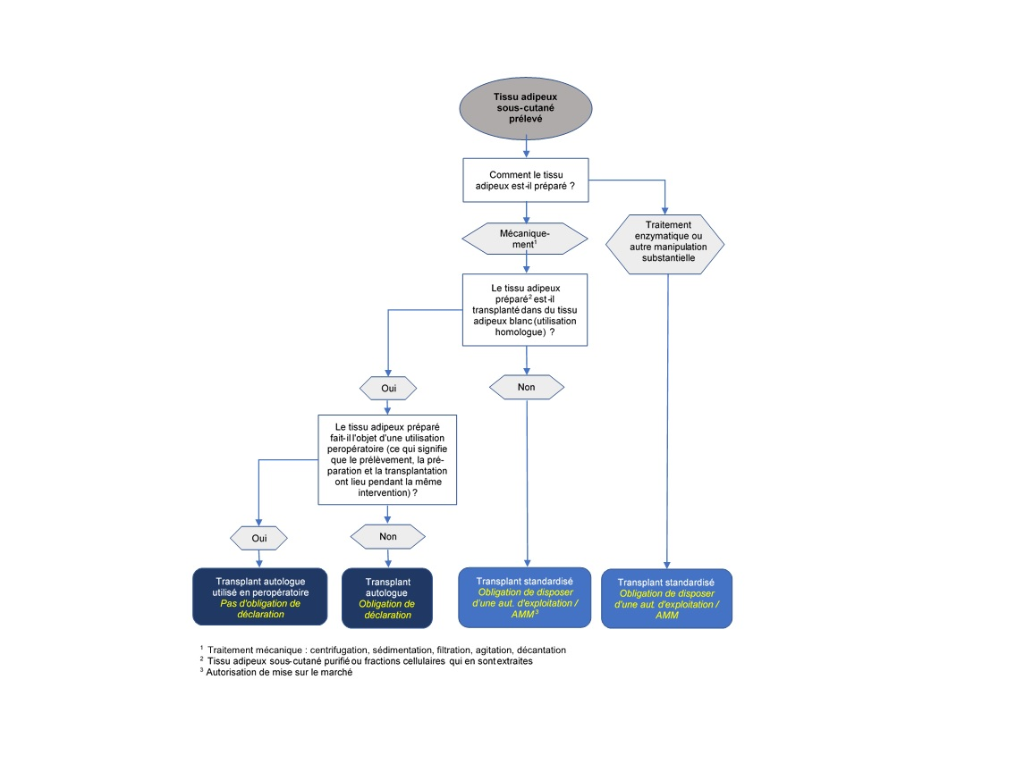
Le tissu adipeux autologue sous-cutané prélevé par liposuccion est préparé selon différents procédés avant la transplantation en fonction de l'usage auquel il est destiné. Ces méthodes de préparation peuvent être synthétisées de la manière suivante :
1. Le tissu adipeux est débarrassé du sang, du sérum, des cellules graisseuses détruites et des liquides indésirables par des moyens mécaniques (sédimentation, filtration, centrifugation, etc.) puis transplanté en tant que tissu adipeux préparé, essentiellement dans l'optique d'augmentations de volume.
2. Le fait de séparer les cellules graisseuses du tissu adipeux permet d'isoler la FVS, qui est utilisée dans un nombre croissant de transplantations en médecine esthétique ou thérapeutique (dans des indications orthopédiques notamment).
La FVS est isolée du tissu adipeux aspiré, soit par une méthode enzymatique, soit par une méthode mécanique:
- La méthode enzymatique repose sur la dissociation, à l'aide d'une protéase, du tissu adipeux aspiré. La fraction huileuse (composée de cellules graisseuses) et la fraction aqueuse sont ensuite séparées par centrifugation, ce qui permet d'obtenir la FVS.
- La méthode mécanique repose sur le transfert, à plusieurs reprises, du tissu adipeux aspiré d'une seringue vers l'autre de manière à le liquéfier et à le transformer en une émulsion grâce aux forces de cisaillement. Ensuite, la fraction huileuse et la fraction aqueuse sont séparées par centrifugation, ce qui permet d'obtenir la FVS. Dans la pratique, l'obtention de la FVS par des moyens mécaniques nécessite la plupart du temps des dispositifs médicaux qui ont été mis au point spécifiquement à cette fin.
Contrairement à la transplantation de graisse autologue, la transplantation de FVS autologue n’est pas au premier chef une transplantation de cellules graisseuses. Il s’agit d’une transplantation de cellules souches graisseuses, de pré-adipocytes, de fibroblastes, de cellules endothéliales vasculaires, ainsi que de cellules immunitaires et de facteurs de croissance divers.
Les dispositions légales à respecter varient en fonction du mode de préparation et de l'utilisation à laquelle le tissu adipeux ou la FVS préparés sont destinés.
Classification légale des tissus adipeux et de la FVS destinés à des transplantations autologues
Sur le plan juridique, le tissu adipeux et la FVS destinés aux transplantations autologues peuvent être divisés en deux groupes (art. 2 de l'ordonnance sur la transplantation, OTx, RS 810.211):
1. « Transplants autologues » (cellules et tissus destinés à des transplantations autologues):
Sont considérés comme des transplants les tissus et cellules qui:
a. ne sont pas soumis à une manipulation substantielle lors de leur préparation, ce qui signifie que leurs propriétés physiologiques et leurs fonctions restent inchangées après les différentes étapes du traitement (manipulation minimale), et
b. assument la même fonction au niveau du site receveur et du site donneur (utilisation homologue).
Les transplants autologues sont soumis à la loi sur la transplantation ainsi qu’à ses dispositions d'exécution. Quiconque prépare, transmet, stocke, importe ou exporte des transplants autologues doit le déclarer à Swissmedic avant le début de l’activité (art. 15d, OTx). La manipulation des tissus et cellules préparés est en outre régie par les articles 13 et 14 de l’OTx.
En vertu de l’art. 1, al. 2, let. b et de l'art. 2, al. 1, let. b de l'OTx, l'obligation de déclaration énoncée à l'art. 15d de cette ordonnance et les dispositions relatives à la manipulation des cellules et des tissus dont il est question aux art. 13 et 14 concernent uniquement les transplants autologues préparés en vue d'une « transplantation ultérieure ». Sont dès lors exemptés de l'obligation de déclaration les cellules et tissus qui sont prélevés, préparés et transplantés au patient pendant la même opération (utilisation peropératoire). En revanche, si les cellules et les tissus sont stockés avant la transplantation autologue ou préparés en vue d'une transplantation future, il ne s'agit plus d'une utilisation peropératoire, de sorte que ce sont les dispositions susmentionnées sur les transplants autologues qui s'appliquent.
2. Transplants standardisés:
Conformément à l'art. 2, let. c et d de l'OTx, les transplants standardisés sont des produits composés d’organes, de tissus ou de cellules d’origine humaine, ou qui en contiennent:
a. lorsque ces organes, tissus ou cellules ont été soumis à une manipulation substantielle, ou
b. n'assument pas la même fonction au niveau du site receveur qu’à celui du site donneur (changement de fonction ou utilisation non homologue).
Les transplants standardisés sont soumis aussi à la LPTh et à ses dispositions d'exécution en sus de la LTx. Or la LPTh dispose que toutes les entreprises et tous les établissements qui fabriquent ou manipulent des transplants standardisés doivent posséder les autorisations d'exploitation idoines délivrées par Swissmedic (art. 5 et 18 LPTh).
En cas d’utilisation chez des patients, il faut en outre qu'une autorisation de mise sur le marché ait été délivrée par Swissmedic soit pour les transplants standardisés en tant que tels (art. 9 LPTh) soit pour le procédé standardisable qui a été suivi pour les fabriquer (art. 32 de l'ordonnance sur les médicaments, OMéd). Dans le cas contraire, ils ne peuvent être employés que dans le cadre d'essais cliniques approuvés et contrôlés par Swissmedic (art. 54 LPTh).
« Manipulation substantielle » et « changement de fonction » : explication des concepts
Lorsqu'il s'agit de classer selon la loi les tissus adipeux autologues et la FVS issue de ces derniers, il y a lieu de déterminer, comme indiqué ci-dessus, si les tissus et cellules en question ont subi ou non une manipulation substantielle et/ou une modification de leurs fonctions.
1. Manipulation substantielle:
On entend par manipulation substantielle au sens de l'art. 2, let. d, OTx, la multiplication des cellules par culture cellulaire, la modification génétique des cellules, et la différenciation ou l’activation des cellules.
Compte tenu de cette définition de la manipulation substantielle dans l'OTx, l’étape de fabrication enzymatique implique également le classement de la FVS en tant que transplant standardisé, puisque le recours à une enzyme lors de la préparation peut influer sur la surface des cellules et, par conséquent, sur la différenciation et sur l'activation de ces dernières. Les tissus adipeux / FVS préparés par digestion enzymatique sont dès lors assimilés à des transplants standardisés. Quant aux méthodes mécaniques, à l'instar de la filtration, de la centrifugation ou de la décantation, elles sont en principe considérées comme des manipulations non substantielles sauf si elles modifient les propriétés physiologiques ou la fonction du tissu ou des cellules.
2. Modification de la fonction:
On parle de modification de la fonction lorsque les cellules ou tissus prélevés ne sont pas utilisés dans l'optique d'assumer, sur un autre site du corps humain, leur fonction initiale de base dans le même environnement histologique.
Dans la mesure où le tissu adipeux sous-cutané est considéré comme du tissu adipeux blanc, il n’y a que dans le cas d’une transplantation vers du tissu adipeux blanc qu’on peut considérer qu’il s'agit du même environnement histologique.
En d'autres termes, on parle de modification de la fonction si du tissu adipeux sous-cutané ou des fractions cellulaires qui en sont extraites sont réinjectés, non pas dans du tissu adipeux blanc à des fins d’augmentation de volume ou de reconstruction, mais dans un autre tissu cible (autre tissu conjonctif lâche, tissu musculaire, ou tissu cutané notamment) ou à une autre fin. Car dans ce cas, l’on ne peut plus considérer que les tissus / cellules assument leur fonction initiale de base.
Compte tenu de ces aspects, le schéma opérationnel ci-après devrait aider à classer sur le plan juridique les tissus adipeux autologues et les fractions cellulaires qui en sont extraites, ainsi qu’à déterminer les obligations qui en découlent en matière de déclarations, d'autorisations de mise sur le marché et d'autorisations d'exploitation.