Situazione di partenza
In medicina estetica, ma anche in altre discipline mediche, vengono sempre più offerti trattamenti basati sul trapianto di tessuto adiposo autologo e della frazione vascolare stromale (SVF) da esso derivata. A questo scopo, si preleva il tessuto adiposo sottocutaneo del paziente, lo si prepara in diversi modi e, successivamente, lo si trapianta in un’altra sede nello stesso paziente (trapianto autologo) per diverse indicazioni, come ad esempio con funzione di riempitivo o per la rigenerazione cutanea o il trattamento dell’artrosi. Il trapianto di tessuto adiposo e SVF è regolamentato dalla legge sui trapianti (LsT, RS 810.21), dalla legge sugli agenti terapeutici (LATer, RS 812.21) e dalla legge sulla ricerca umana (LRUm, RS 810.30).
Il tessuto adiposo e la SVF da esso derivata, che contiene cellule staminali adipose, preadipociti, fibroblasti, cellule endoteliali vascolari e varie cellule immunitarie e fattori di crescita, possono essere classificati dal punto di vista giuridico in due gruppi, per i quali si applicano requisiti legali differenti.
La presente pubblicazione intende spiegare le basi per la classificazione legale e i corrispondenti requisiti legali per il tessuto adiposo e la SVF da esso derivata, utilizzati per i trapianti autologhi.
Differenze di preparazione e utilizzo di tessuto adiposo e frazione vascolare stromale
Il tessuto adiposo sottocutaneo autologo prelevato mediante liposuzione viene trattato prima del trapianto in vari modi, che dipendono dal suo utilizzo finale. I tipi di preparazione si possono riepilogare nel modo seguente:
1. Preparazione meccanica (ad esempio mediante sedimentazione, filtrazione, centrifugazione) per eliminare sangue, siero, cellule adipose distrutte e liquidi indesiderati dal tessuto adiposo, che viene successivamente trapiantato come «tessuto adiposo preparato», principalmente con funzione di riempitivo.
2. Separazione delle cellule adipose dal tessuto adiposo per isolare la SVF, che viene sempre più usata per i trapianti in medicina estetica o a scopo terapeutico, come ad esempio per indicazioni ortopediche.
L’isolamento della SVF dal tessuto adiposo aspirato avviene mediante un metodo enzimatico o meccanico:
- nel metodo enzimatico, il tessuto adiposo aspirato (lipoaspirato) viene scisso enzimaticamente con l’ausilio di una proteasi. Successivamente, la frazione oleosa (costituita da cellule adipose) e la frazione acquosa vengono separate mediante centrifugazione, ottenendo così la SVF;
- nel metodo meccanico, il lipoaspirato viene liquefatto in un’emulsione mediante trasferimento ripetuto del tessuto adiposo tramite siringhe. Successivamente, la frazione oleosa e la frazione acquosa vengono separate mediante centrifugazione e si ottiene così l’SVF. Nella pratica, per ricavare meccanicamente la SVF vengono spesso utilizzati dispositivi medici appositamente sviluppati.
In tal modo, nel trapianto di SVF autologa, a differenza del trapianto di tessuto adiposo autologo, non vengono essenzialmente trapiantate cellule adipose, bensì cellule staminali adipose, preadipociti, fibroblasti, cellule endoteliali vascolari e varie cellule immunitarie nonché fattori di crescita.
A seconda del tipo di preparazione e di utilizzo finale del tessuto adiposo o della SVF, si applicano diverse disposizioni di legge.
Classificazione legale di tessuto adiposo e SVF per il trapianto autologo
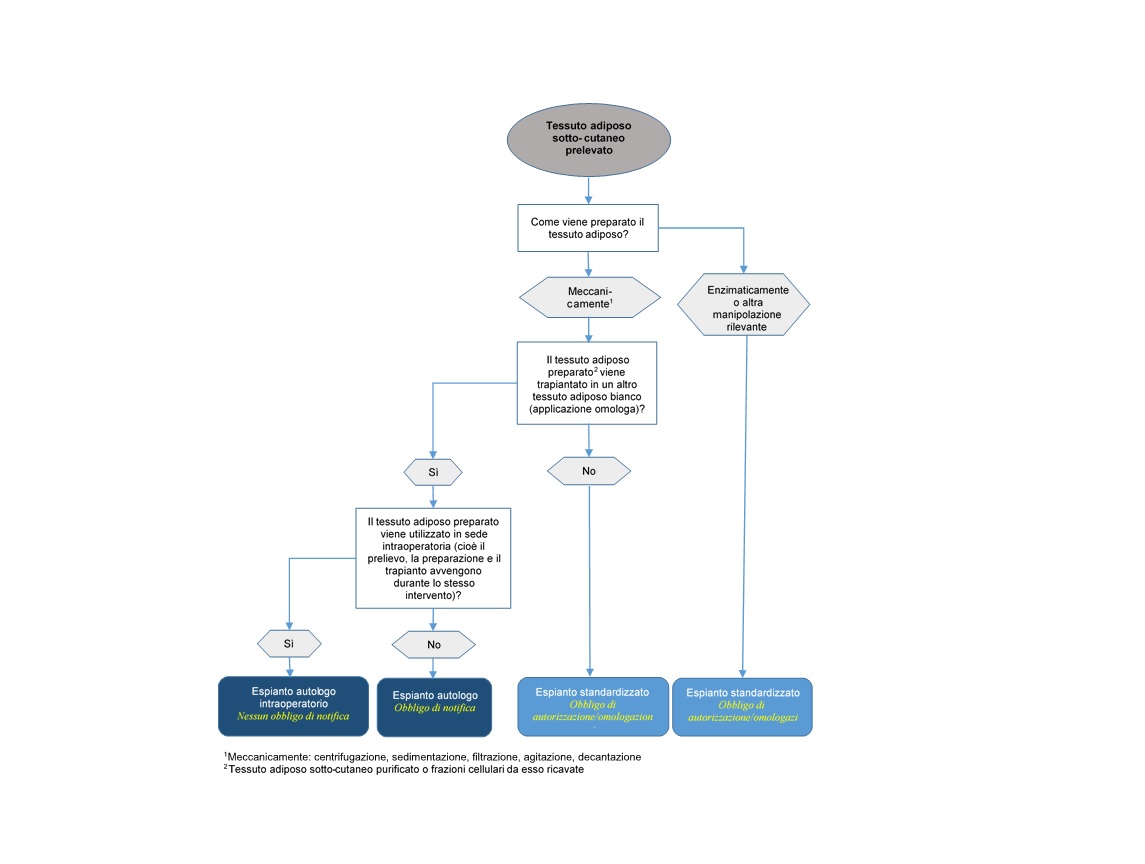
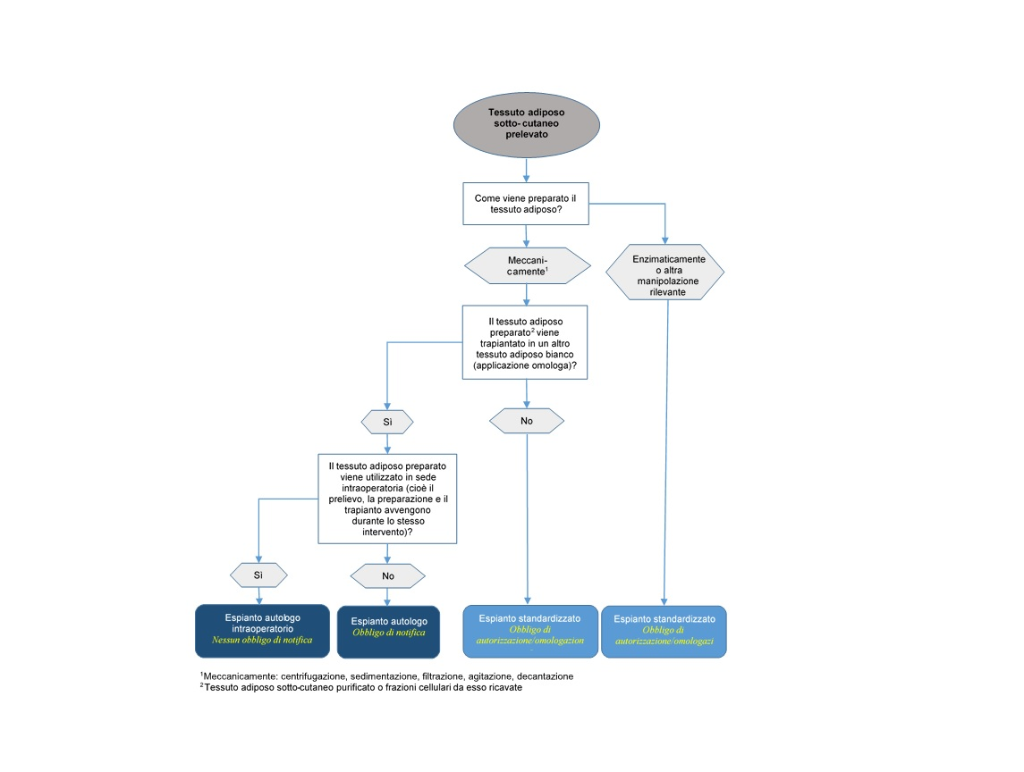
Dal punto di vista giuridico, il tessuto adiposo e la SVF per il trapianto autologo possono essere suddivisi in due gruppi (art. 2 dell’ordinanza sui trapianti, OsT, RS 810.211), vale a dire:
1. Espianti autologhi (cellule e tessuti per trapianto autologo)
Per «espianti» si intendono tessuti e cellule che:
a. durante la preparazione non sono stati sottoposti a una manipolazione rilevante, vale a dire che le loro proprietà e funzioni fisiologiche rimangono invariate dopo le fasi di trattamento (manipolazione minima);
b. nel sito ricevente svolgono la stessa funzione che avevano nel sito di prelievo (applicazione omologa).
Gli espianti aure, importare o esportare espianti autologhi deve preventivamente notificare queste attività a Swissmedic (art. 15d, OsT). Inoltre, l’impiego di tessuti e cellule preparati è soggetto alle disposizioni degli articoli 13 e 14 della OsT.
Ai sensi dell’art. 1 cpv. 2 lett. b e dell’art. 2 cpv. 1 lett. b, l’obbligo di notifica di cui sopra ai sensi dell’art. 15d della OsT, nonché le disposizioni per l’impiego di cellule e tessuti ai sensi degli articoli 13 e 14 della OsT, si applicano solo agli espianti autologhi, qualora siano preparati per un «successivo trapianto». Sono quindi esenti dall’obbligo di notifica le cellule e i tessuti che vengono prelevati, preparati e trapiantati nel paziente durante lo stesso intervento (uso intraoperatorio). Tuttavia, se si conservano le cellule e i tessuti prima del trapianto autologo o li si prepara per un trapianto successivo, non si tratta più di un uso intraoperatorio e si applicano le disposizioni di cui sopra per i trapianti autologhi.
2. Espianti standardizzati
Ai sensi dell’art. 2 lett. c e d della OsT, gli espianti standardizzati sono prodotti costituiti da o contenenti organi, tessuti o cellule di origine umana, laddove questi organi, tessuti o cellule:
a. sono stati sottoposti a una manipolazione rilevante, oppure
b. non sono destinati a svolgere nel ricevente la stessa funzione come nel donatore (modifica della funzione o utilizzo non omologo).
Oltre a sottostare alla LsT, gli espianti standardizzati sono soggetti anche alla LATer e alle sue disposizioni d’esecuzione. Di conseguenza, tutte le imprese e le istituzioni che fabbricano o manipolano espianti standardizzati necessitano delle adeguate autorizzazioni d’esercizio rilasciate da Swissmedic (art. 5 e 18 LATer).
Inoltre, per l’uso sui pazienti Swissmedic deve anche omologare gli espianti standardizzati stessi (art. 9 LATer) o i loro procedimenti di fabbricazione standardizzabili (art. 32 dell’ordinanza sui medicamenti OM), oppure essi possono essere utilizzati solo nell’ambito di uno studio clinico autorizzato e controllato da Swissmedic (art. 54, LATer).
Spiegazione dei termini «manipolazione rilevante» e «cambiamento di funzione»
Nella classificazione legale del tessuto adiposo autologo e della SVF da esso derivata è fondamentale sapere, come descritto sopra, se i tessuti e le cellule sono stati sottoposti a una manipolazione rilevante e/o a un cambiamento di funzione.
1. Manipolazione rilevante
Ai sensi dell’art. 2 lett. d OsT, per manipolazione rilevante si intende la moltiplicazione di cellule mediante coltura cellulare, la modificazione genetica di cellule e la differenziazione o l’attivazione di cellule.
Con questa definizione di manipolazione rilevante, per classificare la SVF come espianto standardizzato viene considerata nella OsT anche la fase di preparazione enzimatica della fabbricazione, poiché questa fase può influenzare la superficie cellulare e quindi la differenziazione e l’attivazione delle cellule. Di conseguenza, il tessuto adiposo e la SVF preparati enzimaticamente sono classificati come espianto standardizzato. I metodi meccanici, come la filtrazione, la centrifugazione o la decantazione, sono generalmente considerati manipolazioni non rilevanti, a meno che non modifichino le proprietà fisiologiche o la funzione del tessuto o delle cellule.
2. Cambiamento di funzione
Un cambiamento di funzione si verifica quando le cellule o i tessuti prelevati non sono utilizzati per svolgere la loro funzione originaria fondamentale in un altro punto del corpo umano nello stesso ambiente istologico.
Siccome il tessuto adiposo sottocutaneo è classificato come tessuto adiposo bianco, lo stesso ambiente istologico si riscontra solo in caso di trapianto all’interno di tessuto adiposo bianco.
Ciò significa che se il tessuto adiposo sottocutaneo o le frazioni cellulari da esso derivate non vengono iniettate in un altro tessuto adiposo bianco con funzione di riempitivo o ricostruzione, ma in un altro tessuto bersaglio (ad esempio altro tessuto connettivo lasso, tessuto muscolare o tessuto cutaneo) o per un altro scopo, assistiamo a un cambiamento di funzione. In questo caso, non si può più partire dal presupposto che i tessuti/le cellule svolgano la loro funzione originaria fondamentale.
Date queste premesse, il seguente diagramma di flusso ha lo scopo di contribuire a definire la classificazione legale di tessuti adiposi autologhi e frazioni cellulari da essi derivate e i relativi obblighi di notifica, omologazione o autorizzazione.