1900
Viene fondato l’Ufficio intercantonale di controllo dei medicamenti (UICM).
Viene fondato l’Ufficio intercantonale di controllo dei medicamenti (UICM).
La Svizzera diventa 33° membro del «Programme for International Drug Monitoring» dell’OMS a Uppsala (Svezia).

Il Consiglio federale sottopone al Parlamento il disegno della nuova legge federale sui medicamenti e i dispositivi medici (Legge sugli agenti terapeutici) nonché il relativo messaggio. Questo disegno di legge, nel quale la Confederazione disciplina per la prima volta in modo esaustivo il controllo degli agenti terapeutici, pone anche le basi per la creazione di un istituto per gli agenti terapeutici a livello federale.
Il Consiglio federale decide di porre in vigore la legge sugli agenti terapeutici e le relative ordinanze il 1° gennaio 2002.
Dalla fusione tra l’UICM e l’Unità principale agenti terapeutici dell’Ufficio federale della sanità pubblica nasce Swissmedic, l’Istituto svizzero per gli agenti terapeutici. Entrano in vigore la legge federale sui medicamenti e i dispositivi medici (Legge sugli agenti terapeutici, LATer) e le relative ordinanze.
Il Consiglio dell’Istituto approva l’acquisto dello stabile della Stämpfli SA, adibito a tipografia, in Hallerstrasse 7 a Berna.
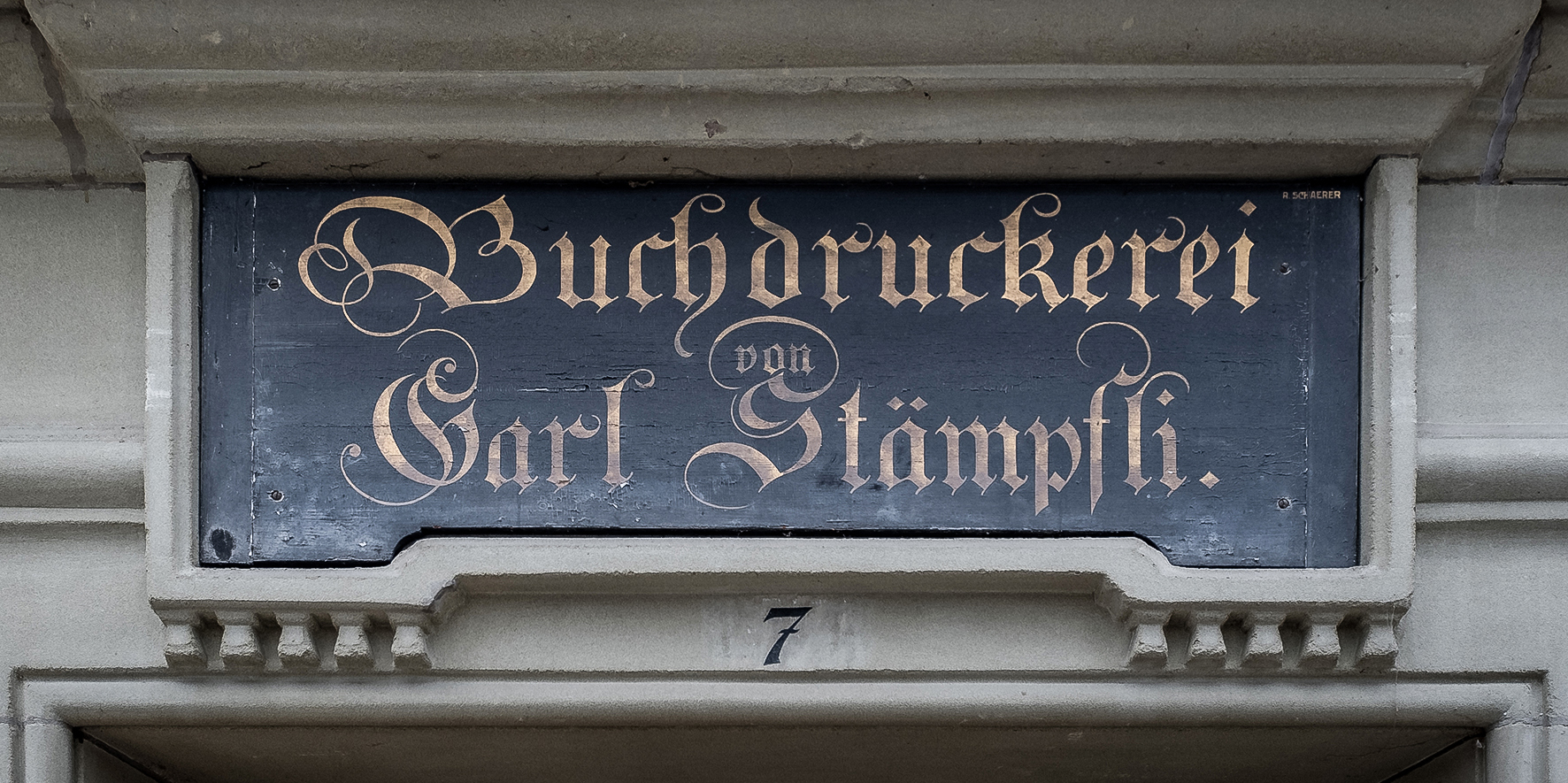
Esce la prima edizione della Pharmacopoea Helvetica pubblicata da Swissmedic (nel complesso si tratta della nona edizione).


La Commissione della gestione del Consiglio degli Stati (CDG-S) pubblica un rapporto sulle difficoltà legate alla creazione di Swissmedic e all’avvio delle sue attività.


Swissmedic accetta le domande di omologazione presentate in formato eCTD, ovvero in formato elettronico, senza documenti cartacei.

La Svizzera firma la «Convenzione Medicrime» del Consiglio d’Europa per combattere la contraffazione di agenti terapeutici.

Swissmedic organizza una conferenza per celebrare il 150° anniversario della Farmacopea svizzera (Ph. Helv.).


Parte il progetto di revisione del diritto sui dispositivi medici: l’entrata in vigore dell’ordinanza sui dispositivi medico-diagnostici in vitro (ODIv) è prevista per maggio 2022.
