1900
L’Office intercantonal de contrôle des médicaments (OICM) est créé.
L’Office intercantonal de contrôle des médicaments (OICM) est créé.
La Suisse devient le 33e membre du PIDM (Programme for International Drug Monitoring) de l’OMS à Uppsala, en Suède.

Le Conseil fédéral transmet au Parlement le projet de la nouvelle loi fédérale sur les médicaments et les dispositifs médicaux (loi sur les produits thérapeutiques) et le message y relatif. C’est la première fois que la Confédération réglemente dans son intégralité le contrôle des produits thérapeutiques. La nouvelle loi pose également les bases de la création au plan fédéral d’un Institut des produits thérapeutiques.
Le Conseil fédéral décide de mettre en vigueur la loi sur les produits thérapeutiques et les ordonnances y afférentes le 1er janvier 2002.
L’OICM fusionne avec l’Unité principale des agents thérapeutiques de l’Office fédéral de la santé publique (OFSP) et devient Swissmedic, Institut suisse des produits thérapeutiques. La loi fédérale sur les médicaments et les dispositifs médicaux (loi sur les produits thérapeutiques, LPTh) et les ordonnances connexes entrent en vigueur.
Le Conseil de l’institut approuve l’acquisition de l’imprimerie de Stämpfli SA, un bâtiment situé Hallerstrasse 7 à Berne.
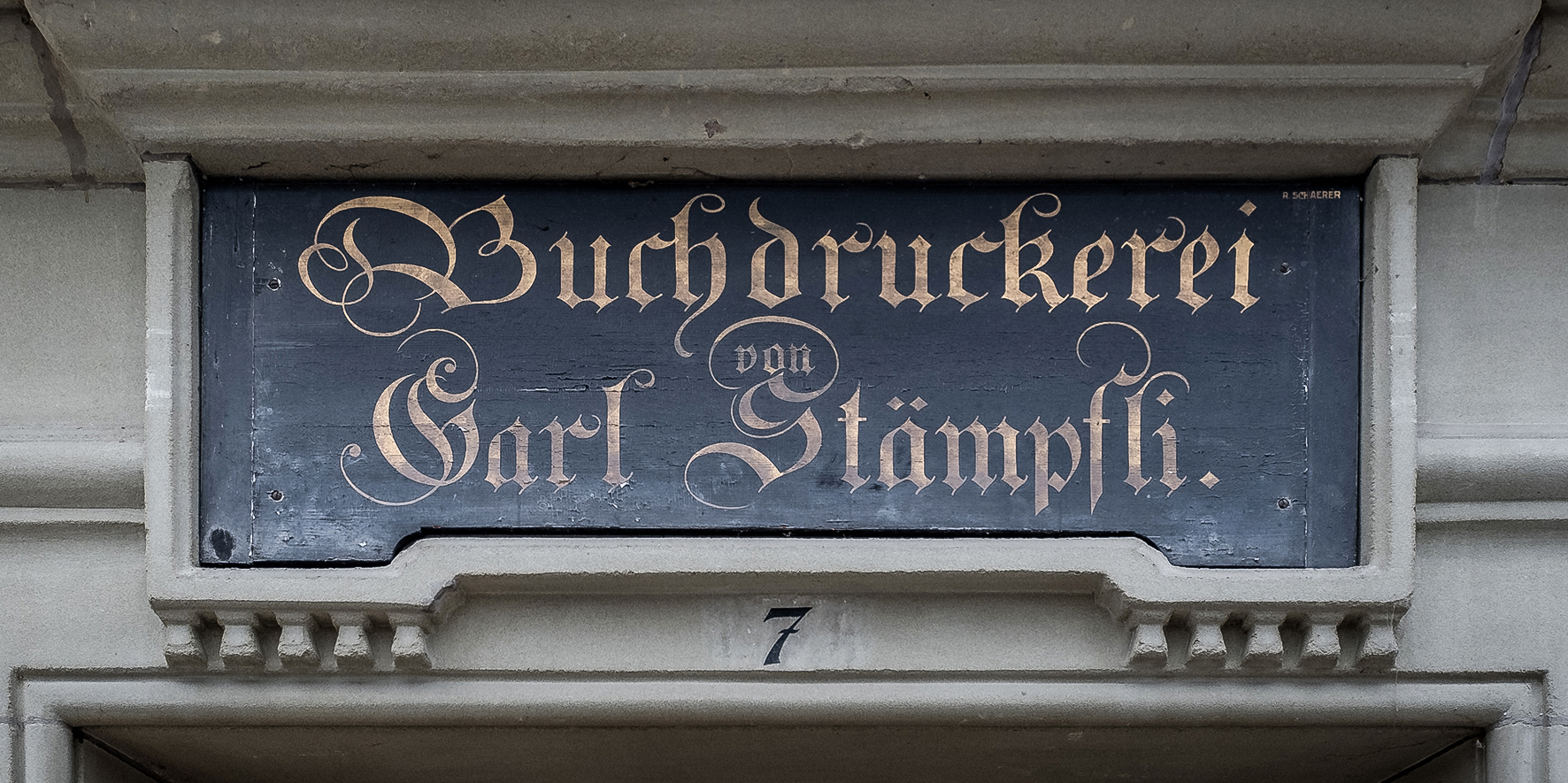
Première publication par Swissmedic de la Pharmacopoea Helvetica (Ph. Helv. 9).


La Commission de gestion du Conseil des États (CdG-E) publie un rapport sur les difficultés rencontrées lors de la création et du démarrage des activités de Swissmedic.


Swissmedic accepte le dépôt de demandes d’autorisation au format eCTD, c’est-à-dire sous forme électronique, sans copie sur papier.

La Suisse signe la Convention Médicrime du Conseil de l’Europe visant à lutter contre les contrefaçons de produits thérapeutiques.

Pour célébrer les 150 ans de la Pharmacopée suisse (Ph. Helv.), Swissmedic organise un colloque.


Le projet de révision de la réglementation sur les dispositifs médicaux est lancé : le règlement (UE) relatif aux dispositifs médicaux de diagnostic in vitro (IvDR) devrait entrer en vigueur en mai 2022.
