1900
Gründung der IKS Interkantonale Kontrollstelle für Heilmittel.
Gründung der IKS Interkantonale Kontrollstelle für Heilmittel.
Die Schweiz wird 33. Mitglied des «WHO International Drug Monitoring Programme» in Uppsala, Schweden.

Der Bundesrat überweist den Entwurf für das neue Bundesgesetz über Arzneimittel und Medizinprodukte (Heilmittelgesetz) zusammen mit der Botschaft an das Parlament. Darin wird die Kontrolle der Heilmittel erstmals umfassend durch den Bund geregelt. Zudem wird die Grundlage für die Gründung eines Heilmittelinstituts auf Bundesebene geschaffen.
Der Bundesrat entscheidet, das Heilmittelgesetz sowie die entsprechenden Verordnungen auf den 1. Januar 2002 in Kraft zu setzen.
Die IKS fusioniert mit der Facheinheit Heilmittel des Bundesamtes für Gesundheit zu Swissmedic, Schweizerisches Heilmittelinstitut. Das Bundesgesetz über Arzneimittel und Medizinprodukte (Heilmittelgesetz, HMG) und die zugehörigen Verordnungen treten in Kraft.
Der Institutsrat stimmt dem Kauf der Druckereiliegenschaft der Stämpfli AG an der Hallerstrasse 7 in Bern zu.
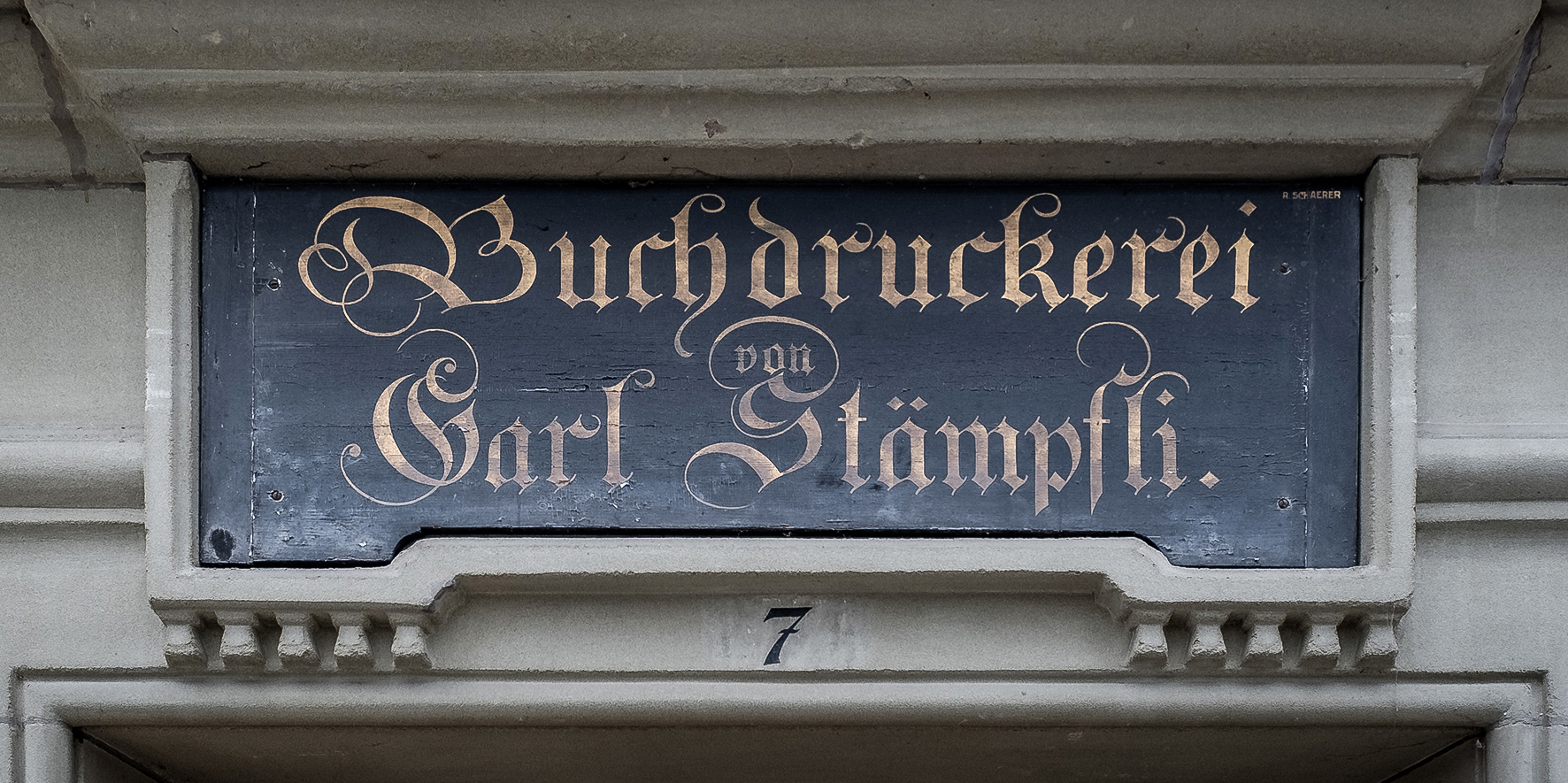
Erstmalige Herausgabe der Pharmacopoea Helvetica durch Swissmedic (insgesamt handelt es sich um die 9. Ausgabe).


Die Geschäftsprüfungskommission des Ständerates (GPK-S) veröffentlicht einen Bericht über die Schwierigkeiten bei der Schaffung und Betriebsaufnahme von Swissmedic.


Swissmedic akzeptiert Zulassungsgesuche im eCTD-Format, das heisst in elektronischer Form, ohne Papierkopien.

Die Schweiz unterzeichnet im Oktober die «Medicrime-Konvention» des Europarates zur Bekämpfung von Fälschungen von Heilmitteln.

Swissmedic feiert das 150-Jahre-Jubiläum der Schweizerischen Pharmakopöe (Ph. Helv.) mit einer Fachtagung.


Projektstart der Medizinprodukte-Regulierungsrevision: Die Verordnung über In-vitro-Diagnostika (IvDV) tritt voraussichtlich im Mai 2022 in Kraft.
